পরমাণুর গঠন
পরমাণুর গঠন : যেকোনো মৌলের শেষ উৎস জানতে পরমাণুর ধারণা প্রথম কল্পনা করা হয় প্রায় খ্রীষ্টজন্মের কয়েক শতাব্দী আগে। এই ব্যাপারে ভারতীয় দার্শনিক ঋষি কণাদকে পরমাণুর ধারণার পথিকৃৎ হিসাবে মনে করা হয়। তাঁর মতে পরমাণু হল সদ্ (অস্থিত্ব আছে এমন কিছু), নিত্য (চিরন্তন, অক্ষয় ও অখন্ডনীয়), এর উৎস বা কারণ নেই। এই বিরাট বিশ্বসংস্থিতির মধ্যে কণামাত্র স্থানে তার অবস্থান। অতি সূক্ষ, চোখে দেখা যায় না অথচ সমস্ত কিছু সৃষ্টির মূলে এই পরমাণু।
ঋষি কণাদের এই ধারণাতে প্রথমে অবাক হয়েছিলেন ডেমোক্রিটাস, লিউপ্পাস বিভিন্ন গ্রীক দার্শনিকগণ। পরে তাঁরা মেনে নেন পরমাণু আছে যার নামকরণ করেছিলেন পরমাণু যার অর্থ Atomos, অর্থাৎ যাকে আর ভাঙা যায় না। এর পরে বেশ শতাব্দী কেটে গেলেও পরমাণু সম্পর্কে আর কেউ কোনো ধারণা দেন নি। অবশেষে 1808 সালে ইংরেজ বিজ্ঞানী জন ডালটন পরমাণু সম্পর্কে একটি ধারণা দেন। ডালটনের পরমাণুবাদই প্রথম পরমাণুকে দার্শনিক চিন্তাধারা থেকে বৈজ্ঞানিক চিন্তাধারায় নিয়ে আসে।
পরমাণুর ধারণা ও পরমাণুর গঠন
পরমাণুর ধারণা এবং ডালটনের পরমাণুবাদ (Concept of Atom and Dalton’s Atomic Theory)
1808 খ্রিস্টাব্দে ইংরেজ বিজ্ঞানী স্যার জন ডালটন পদার্থের গঠন সম্পর্কে একটি সুনির্দিষ্ট বৈজ্ঞানিক তত্ত্ব প্রকাশ করেন । এই তত্ত্বটি ডালটনের পরমাণুবাদ [Dalton’s Atomic Theory] নামে খ্যাত । পরমাণুবাদের মূল কথাগুলি হল :
(১) সব পদার্থই অসংখ্য অতি ক্ষুদ্র অবিভাজ্য নিরেট কণা দ্বারা গঠিত । পদার্থের এই ক্ষুদ্রতম কণার নাম পরমাণু [atom] ।
(২) পরমাণুগুলিকে রাসায়নিক প্রক্রিয়া দ্বারা ভাঙ্গা যায় না, সৃষ্টি করা যায় না বা ধ্বংস করা যায় না । পরমাণু অবিনশ্বর ও অবিভাজ্য ।
(৩) একই মৌলিক পদার্থের পরমাণুগুলি ওজনে ও ধর্মে অভিন্ন ।
(৪) বিভিন্ন মৌলিক পদার্থের পরমাণুগুলি ওজনে ও ধর্মে ভিন্ন ।
(৫) বিভিন্ন মৌলিক পদার্থের পরমাণুগুলি পূর্ণসংখ্যার সরল অনুপাতে পরস্পর যুক্ত হয়ে যৌগিক পদার্থ উত্পন্ন করে । যেমন — 1 : 1, 1 : 2, 2 : 3 ইত্যাদি ।
(৬) একই মৌলিক পদার্থের পরমাণুগুলি এক বা একের অধিক অনুপাতে যুক্ত হয়ে একাধিক যৌগিক পদার্থ উত্পন্ন করে । যেমন — NO, NO2, H2O, H2O2 ….. ইত্যাদি ।
পরমাণুর গঠন (Structure of Atom)
পদার্থের পরমাণু সাধারণত ইলেকট্রন, প্রোটন ও নিউট্রন এই তিনটি মূল কণা নিয়ে গঠিত । কেবলমাত্র সাধারণ হাইড্রোজেনের পরমাণুতে নিউট্রন নেই । প্রত্যেক পরমাণু দুটি অংশে বিভক্ত । যথা —
(i) ধনাত্মক তড়িৎযুক্ত পরমাণু-কেন্দ্রক বা পরমাণুর নিউক্লিয়াস [nucleus]
(ii) নিউক্লিয়াসের বাইরে ইলেকট্রন-মহল [extra nuclear electrons] ।
[i] ধনাত্মক তড়িৎযুক্ত পরমাণু-কেন্দ্রক বা পরমাণুর নিউক্লিয়াস:- বিজ্ঞানী রাদারফোর্ড সোনার পাতে আলফা কণার [α -কণা] বিক্ষেপ পরীক্ষা করে প্রথম নিউক্লিয়াসের ধারণা করেন । পরীক্ষা লব্ধ ফল বিশ্লেষণ করে রাদারফোর্ড সিদ্ধান্ত করেন যে —পরমাণুর কেন্দ্রে একটি ক্ষুদ্র স্থানে পরমাণুর প্রায় সমগ্র ভর এবং ধনাত্মক আধান সঞ্চিত থাকে । পরমাণুর কেন্দ্রে ধনাত্মক আধানযুক্ত, ভারী ও অতি ক্ষুদ্র অংশটির নাম পরমাণু-কেন্দ্রক বা নিউক্লিয়াস ।
[ii] নিউক্লিয়াসের বাইরে ইলেকট্রন মহল:- তড়িৎ নিরপেক্ষ পরমাণুতে প্রোটন ও ইলেকট্রন সমান সংখ্যায় থাকে । ইলেকট্রনগুলি নিউক্লিয়াসের বাইরে পরমাণুর বাকি অংশে বিভিন্ন কক্ষে বিন্যস্ত থাকে । ইলেকট্রনের এই বিন্যাসকে ইলেকট্রন-মহল বলে । পরমাণুর গঠন
পরমাণু কি
কোনো মৌলিক পদার্থের ক্ষুদ্রতম অবিভাজ্য কণা যা রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তাকে পরমাণু বলে। পরমাণুতে কোনো মৌলিক পদার্থের সব ধর্ম বজায় থাকে এবং পরমাণুর স্বাধীনভাবে অস্থিত্ব থাকতে পারে আবার নাও পারে।
তবে বর্তমানে পরমাণু আর অবিভাজ্য নয়। আবিষ্কৃত হয়েছে যেকোনো পরমাণু আবার ইলেকট্রন, প্রোটন ও নিউট্রন নামক তিনটি কনা দিয়ে গঠিত। আর পরমাণু রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না। অংশগ্রহণ করে পরমাণুর মধ্যে থাকা ইলেকট্রন কণাগুলি। এগুলি উচ্চতর শ্রেণিতে বিশদে জানা হবে।
পরমাণুকে প্রকাশ করার নিয়ম:
প্রাচীনকালের বিজ্ঞানীরা সেইসময় যতগুলি পরমাণুর সন্ধান পেয়েছিলেন সেগুলিকে কতকগুলি জটিল চিত্র বা ছবির মাধ্যমে প্রথমে প্রকাশ করা শুরু করেছিলেন। কিন্তু তখন পর্যন্ত আবিষ্কার হওয়া 92 টি মৌলকে এই প্রনালীতে প্রকাশ করা, লেখা বা মনে রাখাও কষ্টকর হয়ে দাঁড়ায়। তখন বিজ্ঞানী বার্জিলিয়াস এই মৌলগুলির পরমাণুগুলিকে সহজভাবে সহজ প্রনালীতে প্রকাশ করার চিন্তাধারা দেন যা আজও আমাদের কাছে গ্রহনযোগ্য, তা হল পরমাণুগুলির চিহ্ন (Symbol)।
চিহ্নের সংজ্ঞা:
মৌলিক পদার্থের নাম যার দ্বারা সংক্ষেপে প্রকাশ করা হয়, তাকে চিহ্ন বলে। অর্থাৎ মৌলিক পদার্থের পরমাণুকে সংক্ষেপে প্রকাশ করাকেই চিহ্ন বলে।
চিহ্ন লেখার নিয়ম:
(1) মৌলিক পদার্থের ইংরাজী নামের প্রথম অক্ষর দিয়ে পরমাণুগুলিকে প্রকাশ করা হয়। যেমন,
বোরন (Boron): B
কার্বন (Carbon): C
নাইট্রোজেন (Nitrogen): N
হাইড্রোজেন (Hydrogen): H
অক্সিজেন (Oxygen): O
সালফার (Sulphur): S
(2) একই প্রথম অক্ষর বিশিষ্ট বিভিন্ন মৌল থাকলে, তখন ওই প্রথম অক্ষরটির সঙ্গে পরের অক্ষরটি বা প্রথম অক্ষরের সঙ্গে জোরে উচ্চারিত অক্সরটি যোগ করে প্রকাশ করতে হয়। যেমন,
ক্যালশিয়াম (Calcium): Ca
ব্রোমিন (Bromine): Br
বিসমাথ (Bismuth): Bi
বেরিয়াম (Barium): Ba
বেরিলিয়াম (Berilium): Be
(3) কিছু মৌলের পরমাণুর নাম ল্যাটিন ভাষা অনুসারে প্রথম একটি অক্ষর বা পরপর দুটি অক্ষর বা প্রথম অক্ষরের সাথে জোরে উচ্চারিত অক্ষরদুটি মিলিয়ে চিহ্ন লেখা হয়। যেমন,
সোডিয়াম (Natrium): Na
পটাশিয়াম (Kalium): K
আয়রণ বা লোহা (Ferrum): Fe
লেড বা সীসা (Plumbum): Pb
টিন (Stannum): Sn
সিলভার বা রূপা (Argentum): Ag
(4) চিহ্ন লিখতে গেলে সবসময় বড় হাতের অক্ষরে (Capital Letter) লিখতে হয়। আর যদি দুটি অক্ষরের হয় তখন প্রথমটি বড় হাতের (Capital Letter), পরেরটি ছোটো হাতের (Small Letter) করে লিখতে হয়। যেমন,
| মৌলের নাম | সঠিক চিহ্ন | ভূল চিহ্ন |
|---|---|---|
| কার্বন | C | c |
| নাইট্রোজেন | N | n |
| সোডিয়াম | Na | So |
| সোডিয়াম | Na | NA |
| সোডিয়াম | Na | na |
| ক্লোরিন | Cl | CL |
কয়েকটি মৌলিক পদার্থের চিহ্ন:
হাইড্রোজেন: H
হিলিয়াম: He
লিথিয়াম: Li
বেরিলিয়াম: Be
বোরন: B
কার্বন: C
নাইট্রোজেন: N
অক্সিজেন: O
ফ্লোরিন: F
নিয়ন: Ne
সোডিয়াম: Na
ম্যাগনেশিয়াম: Mg
অ্যালুমিনিয়াম: Al
সিলিকন: Si
ফসফরাস: P
সালফার: S
ক্লোরিন: Cl
আর্গন: Ar
পটাশিয়াম: K
আরও পড়ুন :
সাবান তৈরির পদ্ধতি
ক্যালশিয়াম: Ca
ক্রোমিয়াম: Cr
ম্যাঙ্গানিজ: Mn
আয়রণ: Fe
কোবাল্ট: Co
নিকেল: Ni
কপার: Cu
জিঙ্ক: Zn
আর্সেনিক: As
ব্রোমিন: Br
ক্রিপটন: Kr
সিলভার: Ag
ক্যাডমিয়াম: Cd
টিন: Sn
আয়োডিন: I
প্ল্যাটিনাম: Pt
সোনা: Au
পারদ: Hg
সীসা: Pb
ইউরেনিয়াম: U
পরমাণুর গঠন
আগেই বলা হয়েছে মৌলিক পদার্থের পরমাণুর স্বাধীন অস্থিত্ব থাকতে পারে আবার নাও পারে। যেমন, আয়রণ, পটাশিয়াম, ক্যালশিয়াম, ম্যাগনেশিয়াম ইত্যাদি কিছু কিছু মৌলের পরমাণু আছে যাদের একদম স্বাধীন অস্থিত্ব আছে। কিন্তু হাইড্রোজেন, অক্সিজেন, নাইট্রোজেন এইরকম অসংখ্য মৌল আছে যাদের পরমাণুর কোনো স্বাধীন সত্ত্বা বা অস্থিত্ব নেই। এদের কি হয়?
এরা সবসময় দুই বা ততোধিক পরমাণু একসাথে জোড় বেঁধে স্বাধীনভাবে অবস্থান করে। যেমন,
(1) হাইড্রোজেনের দুটি পরমাণু একসাথে জোড় বেঁধে একটি যৌগিক পরমাণু তৈরি করে।
(2) অক্সিজেনের দুটি পরমাণু একসাথে জোড় বেঁধে একটি যৌগিক পরমাণু তৈরি করে।
(3) নাইট্রোজেন, ক্লোরিন, ব্রোমিন এদের সবারই দুটি পরমাণু একসাথে জোড় বেঁধে একটি যৌগিক পরমাণু তৈরি করে।
(4) ফসফরাসের চারটি পরমাণু একসাথে জোড় বেঁধে একটি যৌগিক পরমাণু তৈরি করে।
(5) সালফারের আটটি পরমাণু একসাথে জোড় বেঁধে একটি যৌগিক পরমাণু তৈরি করে।
আবার সবসময় যে একই ধরণের পরমাণুগুলি জোড় বাঁধে তা কিন্তু নয়। যেমন,
কিছু প্রশ্নের উত্তর দেখে নেই!!
- নিউট্রন আবিষ্কার করেন — চ্যাডউইক
- ইলেকট্রন হচ্ছে পদার্থের– অতি ক্ষুদ্র কণা
- হাইড্রোজেনের পরমাণুতে কোনটি নেই?– নিউট্রন
- পানিতে অক্সিজেন ও হাইড্রোজেনের অনুপাত কত?- ১:২
- প্রতিটি ইলেকট্রনিক কক্ষে ইলেকট্রনের সংখ্যা- 2n2
- ইউরেনিয়ামের বহুল ব্যবহৃত আইসোটোপটির নাম কি?- U235
- কোন মৌলের পারমাণবিক সংখ্যা হচ্ছে— তার পরমাণুতে প্রোটনের সংখ্যা
- পারমাণবিক সংখ্যার আবিস্কারক কে?— Henry Moseley
- যেসব নিউক্লিয়াসের নিউট্রন সংখ্যা সমান কিন্তু ভর সংখ্যা সমান নয়, তাদের বলা হয়— আইসোটোন
- নিচের কোনটি মূল কণিকা?—- নিউট্রন
- কোন পরমাণুর চতুর্থ কক্ষের ইলেকট্রনের সংখ্যা— ৩২টি
- সোডিয়াম-এর (Na23) একটি পরমাণুতে রয়েছে— ১১টি প্রোটন ও ১২টি নিউটন
- কোন পরমাণুর ভরসংখ্যা হচ্ছে— নিউট্রন ও প্রোটনের সংখ্যার সমষ্টি
- আইসোটোপের ক্ষেত্রে কোনটি সঠিক— প্রোটন সংখ্যা সমান থাকে
- যে সকল নিউক্লিয়াসের নিউট্রন সংখ্যা সমান কিন্তু ভর সংখ্যা সমান নয়, তাদের কি বলা হয়?— আইসোটোন
- পারমাণবিক ওজন কোনটির সমান?— নিউট্রন ও প্রোটনের ওজনের সমান
- সিলিকনের পারমাণবিক সংখ্যা সংখ্যা কত?— ১৪
- ইউরেনিয়ামের আইসোটোপ কোনটি?— সবগুলোই
- পারমাণবিক ভর বা ওজন ধারণার প্রবর্তক কে?— জন ডাল্টন
- নিউক্লিয়ন সংখ্যা A, প্রোটন সংখ্যা P, নিউট্রন সংখ্যা N হলে, পারমাণবিক ভর সংখ্যা–A=P+N
- প্রোটনের–পজেটিভ চার্জ আছে পরমাণুর গঠন
আরও দেখুন : পদার্থের শ্রেণীবিভাগ, পরিবর্তন ও গঠন
- পরমাণুর ভর বলতে কি বুঝায়?-নিউট্রন ও প্রোটনের ভর
- পরমাণু (Atom) চার্জ নিরপেক্ষ হয়, কারণ পরমাণুতে–ইলেকট্রন ও প্রোটনের সংখ্যা সমান
- বস্তু/মৌলিক পদার্থের ক্ষুদ্রতম কণা যা রাসায়নিক প্রক্রিয়ায় অংশগ্রহণ করে, তাকে বলে–পরমাণু
- কোনটি পরমাণুর নিউক্লিয়াসে থকে না?-electron
- ১ গ্রাম হাইড্রোজেন গ্যাসে হাইড্রোজেন পরমাণুর সংখ্যা–৬.০২x১০২৩
- অক্সিজেনের আণবিক ভর কত?-৩২
- বস্তুর ধর্ম ধারণ করে এরকম ক্ষুদ্রতম কণিকার নাম-অণু
- একটি পারমাণবিক কণার–ওজন আছে, আয়তন আছে
- বস্তুর আপেক্ষিক ভর কে আবিষ্কার করেন?-বৈজ্ঞানিক ডাল্টন
- পরমাণুর নিউক্লিয়াসে কি কি থাকে?/পরমাণুর কেন্দ্র গঠিত হয়–নিউট্রন ও প্রোটন
- কোনটি মৌলিক কণিকা নয়?-হাইড্রোজেন পরমাণু
- কোনটিতে ঋণাত্মক আধান থাকে?-ইলেট্রন
- ইউরেনিয়ামের পারমাণবিক সংখ্যা কত?-৯২
- অক্সিজেনের পারমাণবিক ওজন–১৬
- এটমিক সংখ্যা একই হওয়া সত্ত্বেও নিউক্লিয়াসের নিউট্রন সংখ্যা বেশি হওয়ারফলে ভরসংখ্যা বেড়ে যায়, তাদেরকে বলে–আইসোটোপ
- একটি এ্যাটমে কণিকার সংখ্যা কয়টি?-তিনটি
- যেসব পরমাণুর নিউট্রন সংখ্যা সমান থাকে কিন্তু প্রোটন সংখ্যা ও ভর সংখ্যা ভিন্ন হয়, তাদেরকে বলে–আইসোটোন
- পারমাণবিক চুল্লীতে কোন মৌল জ্বালানী হিসাবে ব্যবহৃত হয়?-ইউরেনিয়াম-২৩৫
- একটি ইলেকট্রনে চার্জের পরিমান হল-1.609×10-19 কুলম্ব
- ভারী পানি (Heavy water) এর সংকেত কি?-D2O
- যেসব পরমাণুর কেন্দ্রে প্রোটন সংখ্যা সমান কিন্তু ভর সংখ্যা ভিন্ন হয়, সেগুলোকে বলা হয়-আইসোটোপ পরমাণুর গঠন
এবার আমরা এ বিষয়ে বিভিন্ন পরীক্ষায় আসা Mcq প্রশ্ন গুলো দেখে নেই!!
পরমাণুর গঠন সম্পর্কে
আরও দেখে নেই….
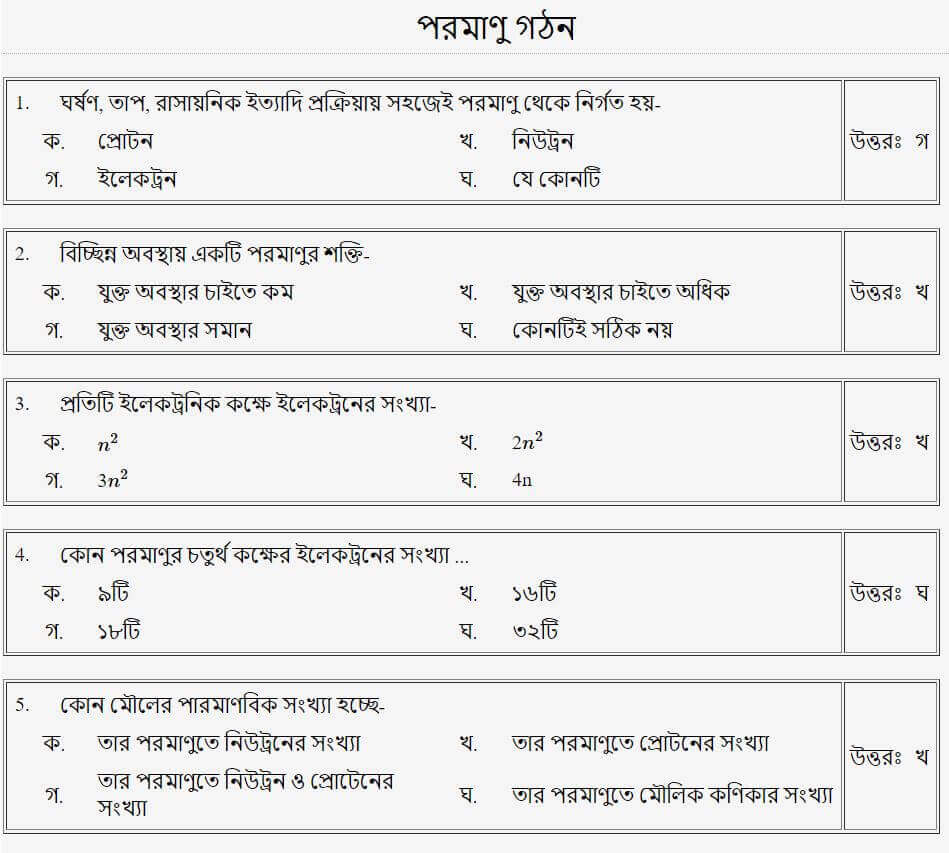
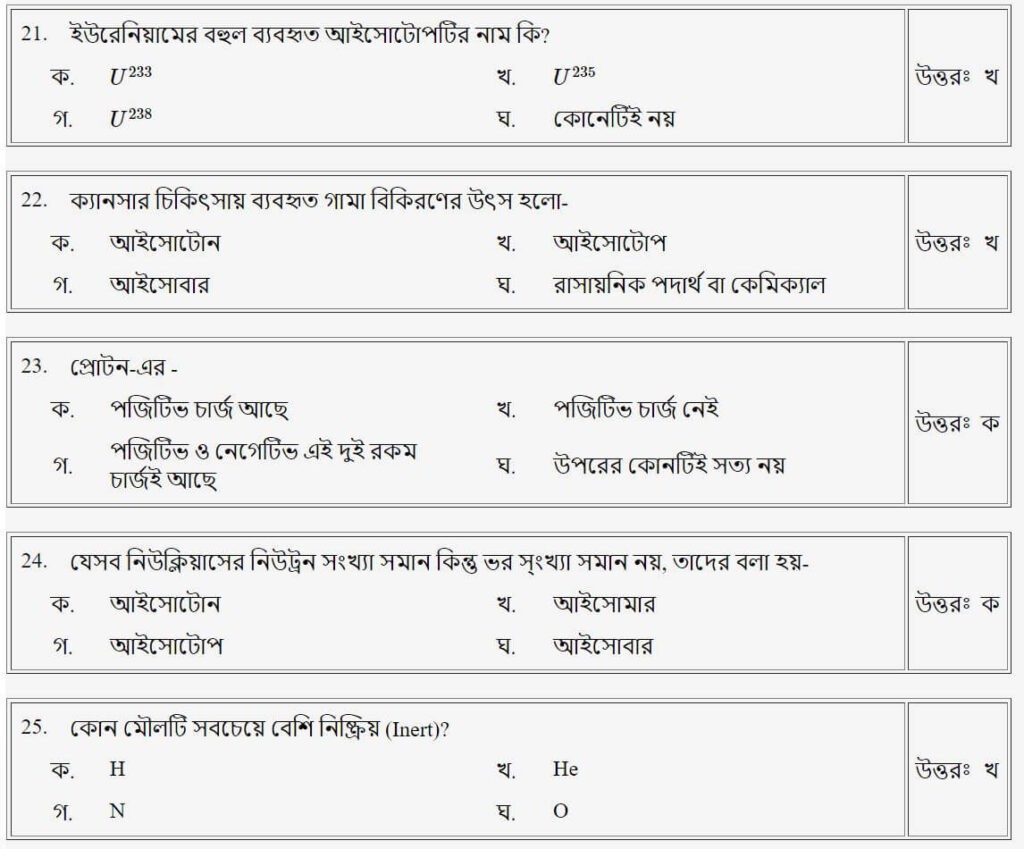
প্রশ্নঃ ১ গ্রাম হাইড্রোজেন গ্যাসে হাইড্রোজেন পরমাণুর সংখ্যা-
- ক.১x১০২৩x১০২৩
- খ.৬.০২x১০২৩
- গ.৩.০১x১০২৩
- ঘ.১৪.০৪x১০২৩
উত্তরঃ খ
প্রশ্নঃ পরমাণুর নিউক্লিয়াসে কি কি থাকে?/পরমাণুর কেন্দ্র গঠিত হয়-
- ক.ইলেট্রন ও প্রোটন
- খ.নিউট্রন ও প্রোটন
- গ.নিউট্রন ও পজিট্রন
- ঘ.ইলেক্ট্রন ও পজিট্রন
উত্তরঃ খ
প্রশ্নঃ পানিতে অক্সিজেন ও হাইড্রোজেনের অনুপাত কত?
- ক.২:১
- খ.১:২
- গ.১৬:১
- ঘ.১:১৬
উত্তরঃ খ
প্রশ্নঃ পরমাণু (Atom) চার্জ নিরপেক্ষ হয়, কারণ পরমাণুতে-
- ক.নিউট্রন ও প্রোটনের সংখ্যা সমান
- খ.প্রোটন ও নিউট্রনের ওজন সমান
- গ.ইলেকট্রন ও প্রোটনের সংখ্যা সমান
- ঘ.নিউট্রন ও প্রোটন নিউক্লিয়াসে থাকে
উত্তরঃ গ
প্রশ্নঃ পারমাণবিক ভর বা ওজন ধারণার প্রবর্তক কে?
- ক.গাউস
- খ.গে লুস্যাক
- গ.জন ডাল্টন
- ঘ.ডেমোক্রিটাস
উত্তরঃ গ
প্রশ্নঃ বস্তুর ধর্ম ধারণ করে এরকম ক্ষুদ্রতম কণিকার নাম
- ক.অণু
- খ.পরমাণু
- গ.কণা
- ঘ.মৌল
উত্তরঃ ক
প্রশ্নঃ কোন মৌলের পারমাণবিক সংখ্যা হচ্ছে
- ক.তার পরমাণুতে নিউট্রনের সংখ্যা
- খ.তার পরমাণুতে প্রোটনের সংখ্যা
- গ.তার পরমাণুতে নিউট্রন ও প্রোটনের সংখ্যা
- ঘ.তার পরমাণুতে মৌলিক কণিকার সংখ্যা
উত্তরঃ খ
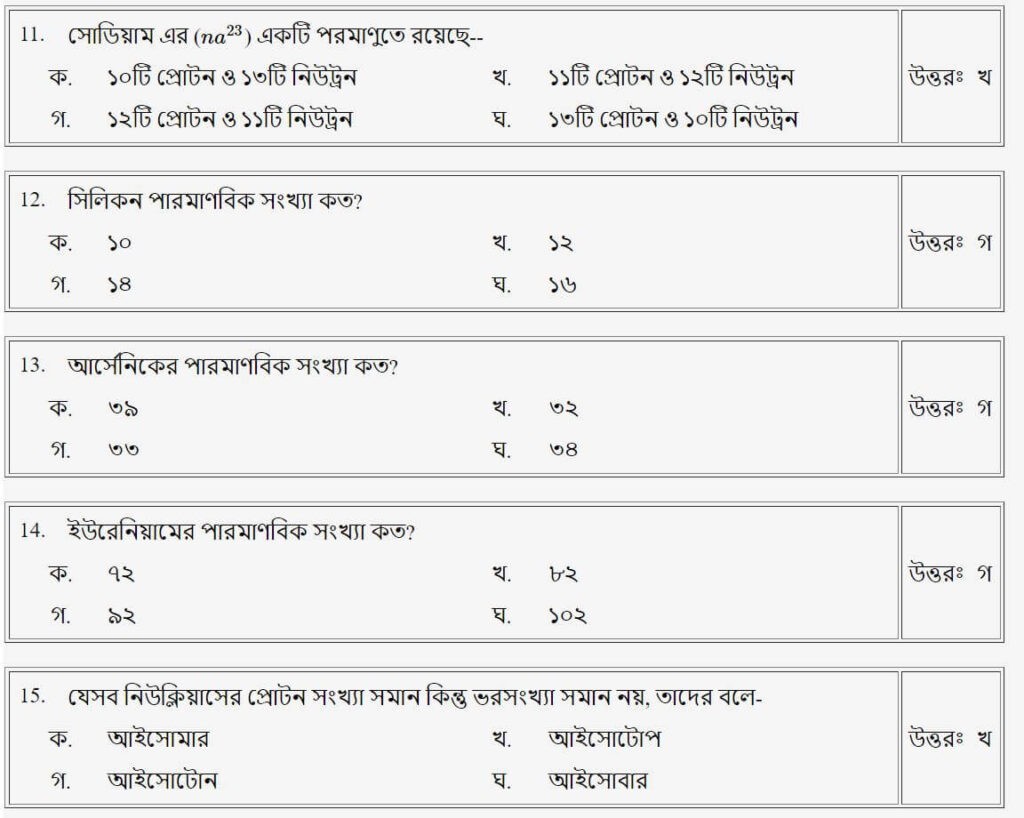
প্রশ্নঃ ইউরেনিয়ামের পারমাণবিক সংখ্যা কত?
- ক.৭২
- খ.৮২
- গ.৯২
- ঘ.১০২
উত্তরঃ গ
প্রশ্নঃ নিউট্রন আবিষ্কার করেন-
- ক.কিউরি
- খ.রাদারফোর্ড
- গ.চ্যাডউইক
- ঘ.থমসন
উত্তরঃ গ
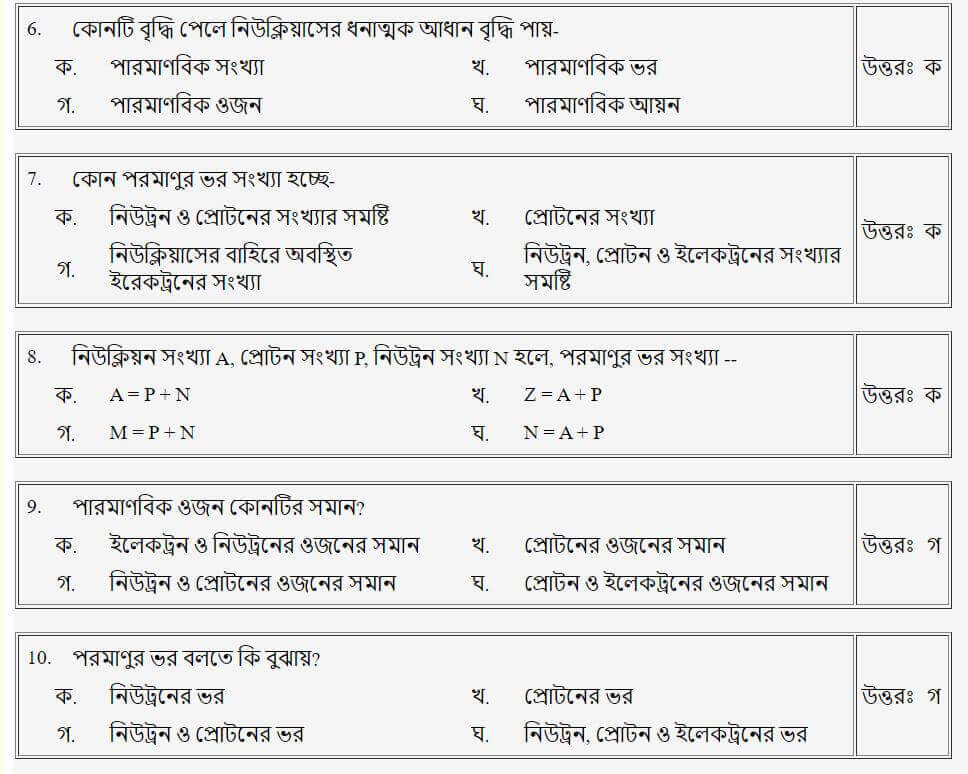
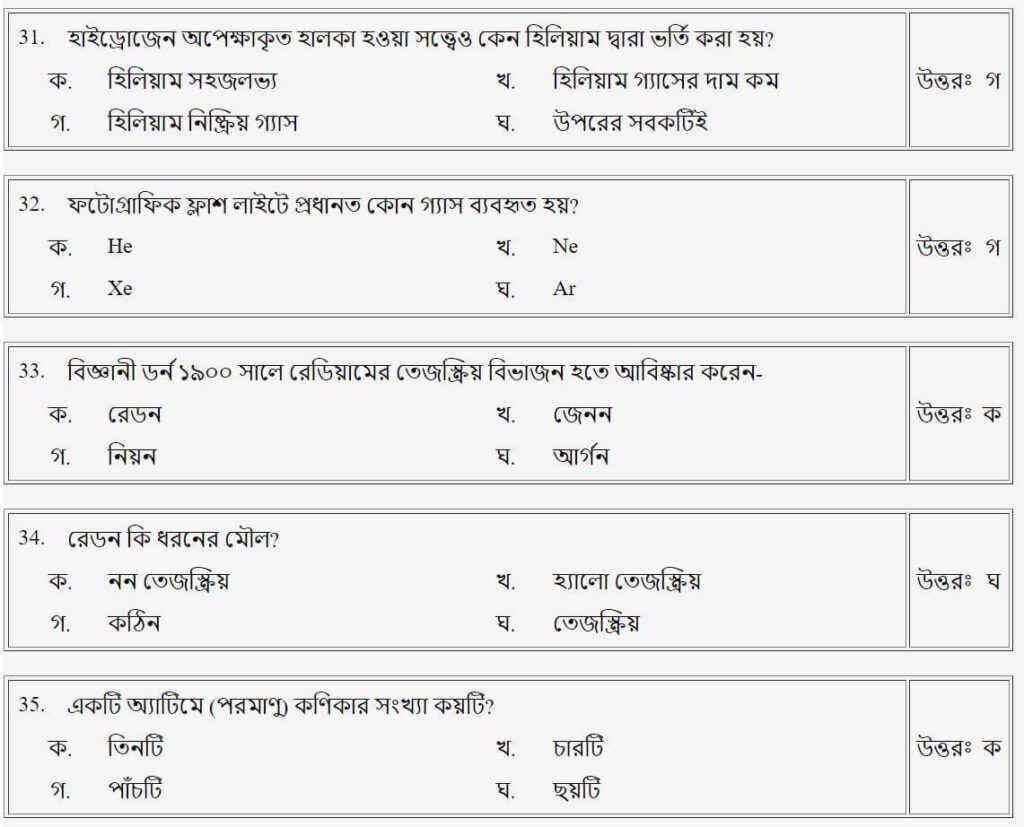
প্রশ্নঃ পরমাণুর ভর বলতে কি বুঝায়?
- ক.নিউট্রনের ভর
- খ.প্রোটনের ভর
- গ.নিউট্রন ও প্রোটনের ভর
- ঘ.নিউট্রন, প্রোটন ও ইলেকট্রনের ভর
উত্তরঃ গ
প্রশ্নঃ বস্তুর আপেক্ষিক ভর কে আবিষ্কার করেন?
- ক.বৈজ্ঞানিক আর্কিমেডিস
- খ.বৈজ্ঞানিক ডাল্টন
- গ.গ্যালিলও
- ঘ.বৈজ্ঞানিক আইনস্টাইন
উত্তরঃ খ
প্রশ্নঃ একটি পারমাণবিক কণার-
- ক.আয়তন নেই, ওজন আছে
- খ.ওজন আছে, আয়তন আছে
- গ.আয়তন আছে, ওজন নেই
- ঘ.আয়তন নেই, ওজন নেই
উত্তরঃ খ
প্রশ্নঃ নিউক্লিয়ন সংখ্যা A, প্রোটন সংখ্যা P, নিউট্রন সংখ্যা N হলে, পারমাণবিক ভর সংখ্যা-
- ক.A=P+N
- খ.Z=A+P
- গ.M=P+N
- ঘ.N=A+P
উত্তরঃ ক
প্রশ্নঃ একটি এ্যাটমে কণিকার সংখ্যা কয়টি?
- ক.তিনটি
- খ.চারটি
- গ.পাঁচটি
- ঘ.ছয়টি
উত্তরঃ ক
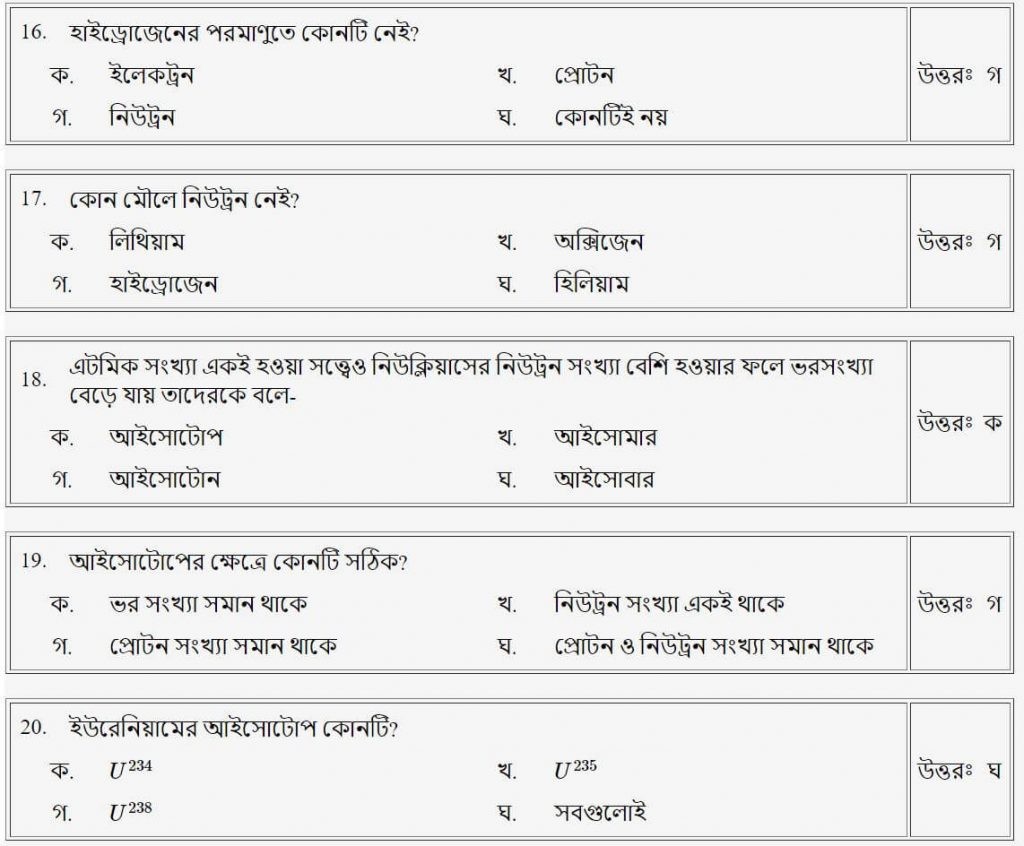
প্রশ্নঃ আইসোটোপের ক্ষেত্রে কোনটি সঠিক
- ক.ভরসংখ্যা সমান থাকে
- খ.নিউট্রন সংখ্যা একই থাকে
- গ.প্রোটন ও নিউট্রন সংখ্যা সমান থাকে
- ঘ.প্রোটন সংখ্যা সমান থাকে
উত্তরঃ ঘ
প্রশ্নঃ আর্সেনিকের পারমাণবিক সংখ্যা কত?
- ক.৩৯
- খ.৩২
- গ.৩৩
- ঘ.৩৪
উত্তরঃ গ
প্রশ্নঃ 3517Cl মৌলের নিউট্রন সংখ্যা কত?
- ক.17
- খ.18
- গ.35
- ঘ.70
উত্তরঃ খ
প্রশ্নঃ হাইড্রোজেনের পরমাণুতে কোনটি নেই?
- ক.ইলেকট্রন
- খ.প্রোটন
- গ.নিউট্রন
- ঘ.কোনটিই নয়
উত্তরঃ গ
প্রশ্নঃ যেসব নিউক্লিয়াসের নিউট্রন সংখ্যা সমান কিন্তু ভর সংখ্যা সমান নয়, তাদের বরা হয়-
- ক.আইসোটোন
- খ.আইসোমার
- গ.আইসোটোপ
- ঘ.আইসোবার
উত্তরঃ ক
প্রশ্নঃ পারমাণবিক ওজন কোনটির সমান?
- ক.ইলেকট্রন ও নিউট্রনের ওজনের সমান
- খ.প্রোটনের ওজনের সমান
- গ.নিউট্রন ও প্রোটনের ওজনের সমান
- ঘ.প্রোটন ও ইলেকট্রনে রওজনের সমান
উত্তরঃ গ
প্রশ্নঃ ইউরেনিয়ামের বহুল ব্যবহৃত আইসোটোপটির নাম কি?
- ক.U233
- খ.U235
- গ.U238
- ঘ.কোনটিই নয়
উত্তরঃ খ
প্রশ্নঃ প্রতিটি ইলেকট্রনিক কক্ষে ইলেকট্রনের সংখ্যা
- ক.n2
- খ.2n2
- গ.3n2
- ঘ.4n2
উত্তরঃ খ
প্রশ্নঃ অক্সিজেনের আণবিক ভর কত?
- ক.১৬
- খ.১৬ গ্রাম
- গ.৩২
- ঘ.৩২ গ্রাম
উত্তরঃ গ
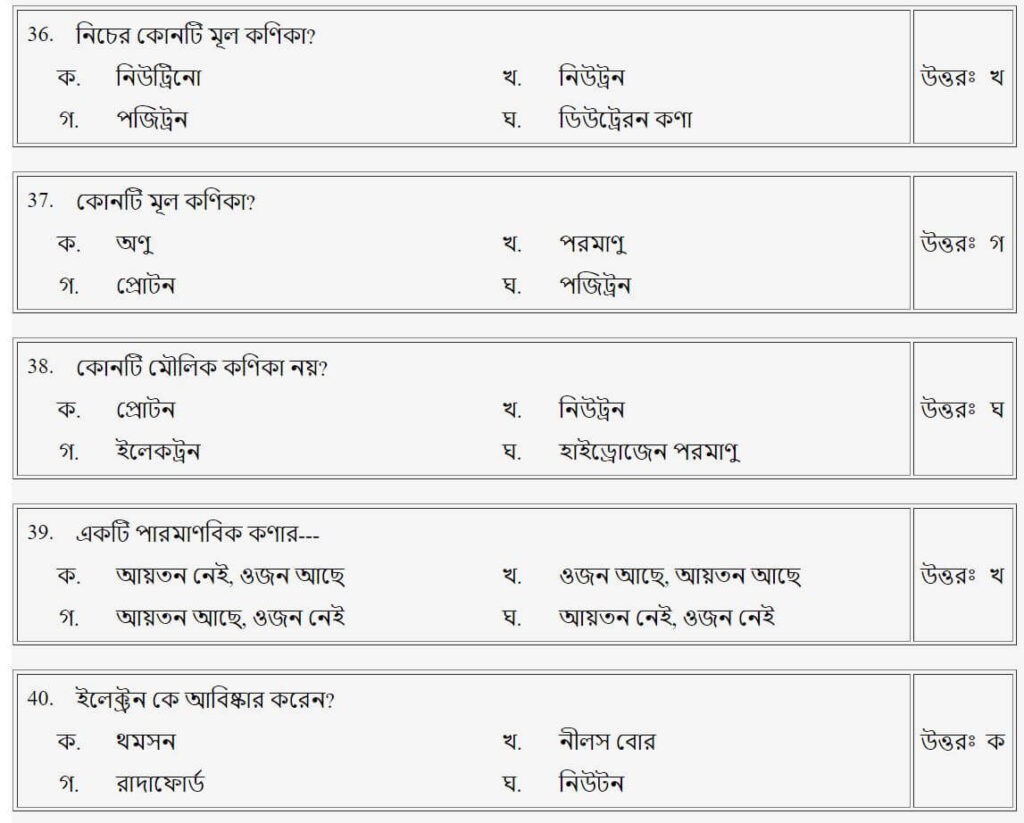
প্রশ্নঃ নিচের কোনটি মূল কণিকা?
- ক.নিউট্রিনো
- খ.নিউট্রন
- গ.পজিট্রন
- ঘ.ডিউট্রেরন কণা
উত্তরঃ খ
প্রশ্নঃ যে সকল নিউক্লিয়াসের নিউট্রন সংখ্যা সমান কিন্তু ভর সংখ্যা সমান নয়, তাদের কি বলা হয়?
- ক.আইসোটোপ
- খ.আইসোটোন
- গ.আইসোবার
- ঘ.আইসোমার
উত্তরঃ খ
প্রশ্নঃ যেসব পরমাণুর কেন্দ্রে প্রোটন সংখ্যা সমান কিন্তু ভর সংখ্যা ভিন্ন হয়, সেগুলোকে বলা হয়
- ক.আইসোটোন
- খ.আইসোটোপ
- গ.আইসোবার
- ঘ.আইসোমার
উত্তরঃ খ
প্রশ্নঃ যেসব পরমাণুর নিউট্রন সংখ্যা সমান থাকে কিন্তু প্রোটন সংখ্যা ও ভর সংখ্যা ভিন্ন হয়, তাদেরকে বলে-
- ক.আইসোটোপ
- খ.আইসোবার
- গ.আইসোটোন
- ঘ.আইসোমার
উত্তরঃ গ
প্রশ্নঃ কোনটিতে ঋণাত্মক আধান থাকে?
- ক.ইলেট্রন
- খ.প্রোটন
- গ.নিউট্রন
- ঘ.নিউক্লিয়াস
উত্তরঃ ক
প্রশ্নঃ এটমিক সংখ্যা একই হওয়া সত্ত্বেও নিউক্লিয়াসের নিউট্রন সংখ্যা বেশি হওয়ারফলে ভরসংখ্যা বেড়ে যায়, তাদেরকে বলে-
- ক.আইসোটোপ
- খ.আইসোমার
- গ.আইসোটোন
- ঘ.আইসোবার
উত্তরঃ ক
প্রশ্নঃ পারমাণবিক চুল্লীতে কোন মৌল জ্বালানী হিসাবে ব্যবহৃত হয়?
- ক.পেট্রোলিয়াম
- খ.ইউরেনিয়াম-২৩৫
- গ.অক্সিজেন
- ঘ.প্লাটিনাম
উত্তরঃ খ
প্রশ্নঃ অক্সিজেনের পারমাণবিক ওজন-
- ক.১২
- খ.১৪
- গ.১৬
- ঘ.১৮
উত্তরঃ গ
প্রশ্নঃ কোনটি মৌলিক কণিকা নয়?
- ক.প্রোটন
- খ.নিউট্রন
- গ.ইলেক্ট্রন
- ঘ.হাইড্রোজেন পরমাণু
উত্তরঃ ঘ
প্রশ্নঃ একটি ইলেকট্রনে চার্জের পরিমান হল
- ক.1.7×10-8 কুলম্ব
- খ.9×1011 কুলম্ব
- গ.1.609×10-19 কুলম্ব
- ঘ.1.609×10-9 কুলম্ব
উত্তরঃ গ
প্রশ্নঃ পারমাণবিক সংখ্যার আবিস্কারক কে?
- ক.Robert Norman
- খ.Sir Thomas Browne
- গ.Henry Moseley
- ঘ.James Clerk Maxwell
উত্তরঃ গ
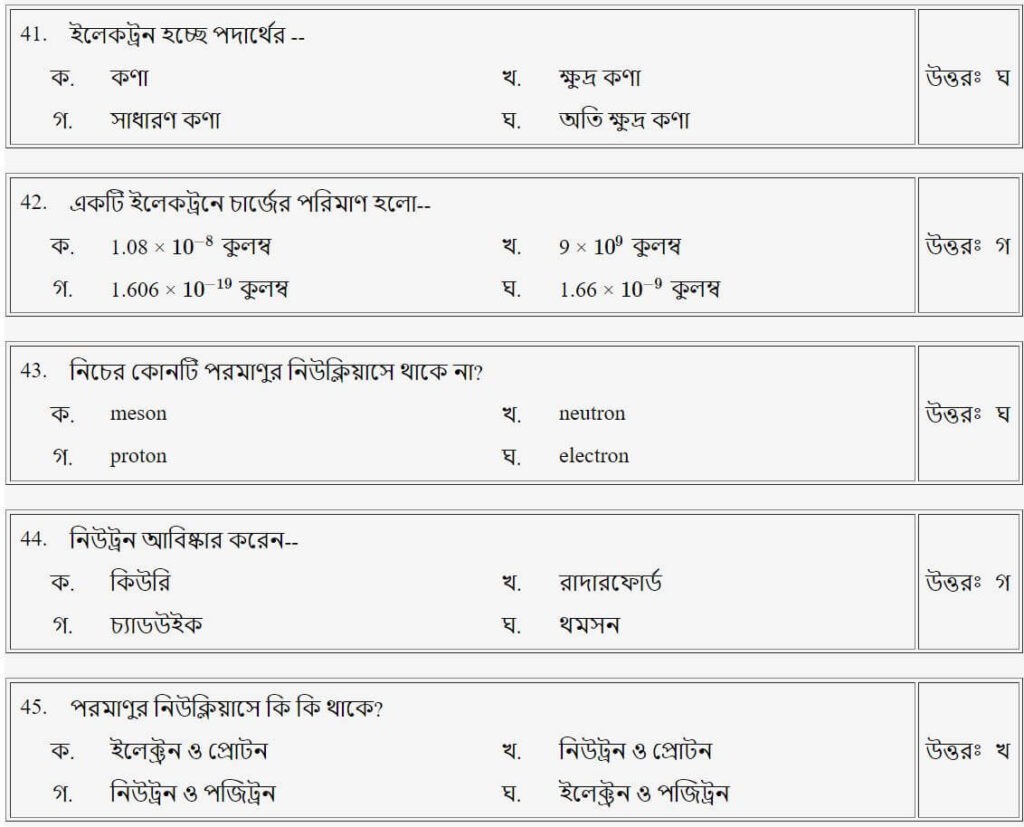
প্রশ্নঃ ইলেকট্রন হচ্ছে পদার্থের
- ক.কণা
- খ.ক্ষুদ্র কণা
- গ.সাধারণ কণা
- ঘ.অতি ক্ষুদ্র কণা
উত্তরঃ ঘ
প্রশ্নঃ Boron এবং Zirconium নাম দুটি কোন ভাষা থেকে এসেছে?
- ক.গ্রীক
- খ.ল্যাটিন
- গ.আরবি
- ঘ.ইংরেজি
উত্তরঃ গ
প্রশ্নঃ কোন পরমাণুর চতুর্থ কক্ষের ইলেকট্রনের সংখ্যা
- ক.৯টি
- খ.১৬টি
- গ.১৮টি
- ঘ.৩২টি
উত্তরঃ ঘ
প্রশ্নঃ ভারী পানি (Heavy water) এর সংকেত কি?
- ক.2H2O2
- খ.H2O
- গ.D2O
- ঘ.HD2O2
উত্তরঃ গ
প্রশ্নঃ বস্তু/মৌলিক পদার্থের ক্ষুদ্রতম কণা যা রাসায়নিক প্রক্রিয়ায় অংশগ্রহণ করে, তাকে বলে-
- ক.অণু
- খ.পরমাণু
- গ.ইলেকট্রন
- ঘ.প্রোটন
উত্তরঃ খ
প্রশ্নঃ কোন পরমাণুর ভরসংখ্যা হচ্ছে
- ক.নিউট্রন ও প্রোটনের সংখ্যার সমষ্টি
- খ.প্রোটনের সংখ্যা
- গ.নিউক্লিয়াসের বাহিরে অবস্থিত ইলেকট্রনের সংখ্যা
- ঘ.নিউট্রন, প্রোটন ও ইলেকট্রনের সংখ্যার সমষ্টি
উত্তরঃ ক পরমাণুর গঠন
প্রশ্নঃ ইউরেনিয়ামের আইসোটোপ কোনটি?
- ক.U234
- খ.U235
- গ.U238
- ঘ.সবগুলোই
উত্তরঃ ঘ
প্রশ্নঃ কোনটি পরমাণুর নিউক্লিয়াসে থকে না?
- ক.meson
- খ.neutron
- গ.proton
- ঘ.electron
উত্তরঃ ঘ
প্রশ্নঃ সোডিয়াম-এর (Na23) একটি পরমাণুতে রয়েছে-
- ক.১০টি প্রোটন ও ১৩টি নিউট্রন
- খ.১১টি প্রোটন ও ১২টি নিউটন
- গ.১২ টি প্রোটন ও ১১টি নিউটন
- ঘ.১৩টি প্রোটন ও ১০টি নিউটন
উত্তরঃ খ
প্রশ্নঃ প্রোটনের-
- ক.পজেটিভ চার্জ আছে
- খ.পজেটিভ ও নেগেটিভ এই দুই রকম চার্জই আছে
- গ.পজেটিভ চার্জ নেই
- ঘ.উপরের কোনোটিই সত্য নয়
উত্তরঃ ক
প্রশ্নঃ সিলিকনের পারমাণবিক সংখ্যা সংখ্যা কত?
- ক.১০
- খ.১২
- গ.১৪
- ঘ.১৬
উত্তরঃ গ
আমাদের পোষ্ট গুলো প্রতিনিয়ত আপডেট করা হয়। বিসিএস,প্রাইমারি সহ সব পরীক্ষার প্রতিনিয়ত প্রশ্ন অনুযায়ী পোষ্ট গুলো আমরা আপডেট করি। সবার জন্য শুভ কামনা রইলো।
এতক্ষন আমাদের সাথে থাকার জন্য ধন্যবাদ!
