এন্ট্রপি কি: এন্ট্রপি কি ও এনট্রপির পরিবর্তন এবং এনট্রপির মাত্রা সম্পর্কে এখানে বিস্তারিত ভাবে জানতে পারবেন,এরপর আর কোন এ সম্পর্কে প্রশ্ন মনে জাগবে না। তাহলে চলুন দেখা যাক।
এনট্রপি
এন্ট্রপি (Entropy) গ্রিক শব্দ `a turning toward’ থেকে Entropy (এন্ট্রপি) শব্দটিকে নেওয়া হয়েছে ( in+tropy অর্থ a turning ) । এন্ট্রপির একক হচ্ছে “Joule/K” জুল/কেলভিন। হচ্ছে বস্তুর একটি ভৌত ধর্ম। তাপগতিবিজ্ঞানে এর গুরুত্ব অপরিসীম। এটি তাপগতীয় রাশিসমূহের এমন একটি অপেক্ষক, যা তাপ প্রবাহের দিক বা তাপ সঞ্চালনের দিক নির্দেশ করে এবং তাপগতীয় অবস্থা নির্ধারণে সহায়তা করে। ইহা বস্তুর একটা ভৌত গুণ।
একে তাপীয় জড়তা বলে। এন্ট্রপি একটি পরিমেয় রাশি। কোনো সিস্টেমের এন্ট্রপি কত পরিবর্তন হলো তা নির্ণয় করা যায়। তাপমাত্রা, তাপমাত্রা ও চাপের মতো বস্তুর এন্ট্রপিও একটি প্রাকৃতিক রাশি। এর মান বস্তুর বর্তমান অবস্থার উপর নির্ভর করে।
তবে কোন পথে বস্তু ঐ অবস্থায় পৌঁছল তার উপর নির্ভর করে না অর্থাৎ কোনো নির্দিষ্ট অবস্থায় বস্তুর এন্ট্রপি বস্তুর পূর্ব ইতিহাসের উপর নির্ভর করে না। তাপ গ্রহণে বা বর্জনে বস্তুর এন্ট্রপি পরিবর্তিত হয়।
কোনো প্রক্রিয়ায় (process) আগাগোড়াই যদি তাপীয় সাম্যাবস্থা সংরক্ষিত থাকে, তাহলে সেখানে বিশৃঙ্খলা-মাত্রার মানও অপরিবর্তিত থাকে। রুদ্ধতাপীয় প্রক্রিয়ায় বস্তুর যে তাপগতীয় চলরাশি বা তাপীয় ধর্ম স্থির থাকে, তাকে এনট্রপি বলে। এন্ট্রপি কি
এককথায় বলতে গেলে “মলিকুলার ডিসঅর্ডার বা পরমাণুর অস্থিতিশীলতা”
তার আগে আসুন জেনে নেই পরমশূন্য তাপমাত্রা কি?
পরমশূন্য তাপমাত্রা
যে তাপমাত্রায় কোন বস্তুর প্রতিটি কণার বেগ শূন্য থাকে , তাকে ঐ বস্তুর পরমশূন্য তাপমাত্রা বলে।
ফলে এখানে পরমাণু গুলো স্থিতিশীল থাকবে আর বস্তুর ভৌত অবস্থা ক্রিস্টাল সলিডিয়।উদাহরণ সরূপ পানির পরমশূন্য তাপমাত্রা ০° কেলভিন। অর্থাৎ, ০° কেলভিন তাপমাত্রায় পানির কণাগুলো বেগ শূন্য বা পরমাণু স্থিতিশীল থাকে,তাই এখানে এনট্রপির মান শূন্য। থার্মোডাইনামিক্সের তৃতীয় সূত্রে এটাই বলা আছে। তাপমাত্রা বাড়ার সাথে সাথে পানির পরমাণুগুলোর গতি শক্তি বৃদ্ধি পেতে থাকে।
ফলে পরমাণুগুলো উচ্চগতিতে এদিক ওদিক ছুটাছুটি করতে থাকে। যেটাকে আমরা পরমাণুর অস্থিতিশীলতা মানে এন্ট্রপির বৃদ্ধি বলতে পারি।
গ্যাসীয় অবস্থায় পানির তাপমাত্রা বেশি থাকে, আর এখানে পরমাণু গুলো বেশি অস্থিতিশীল
হওয়ায় এন্ট্রপির মানও বেশি হবে।সহজে বলতে গেলে এন্ট্রপি হলো তাপমাত্রার একটি ফাংশন,যার মান তাপমাত্রা বাড়ার সাথে সাথে বৃদ্ধি পায়,
আবার তাপমাত্রা কমলে হ্রাস পায়। এন্ট্রপি কি
বিঃদ্রঃ পরমাণুর গতিশক্তিই হল তাপমাত্রা, যে পরমাণুর গতিশক্তি যত বেশি তার তাপমাত্রা তত বেশি।
এনট্রপির মান থেকে কোনো প্রক্রিয়ার উভমুখিতা, একাভিমুখীতা বা স্বতঃস্ফুর্ততা, অপ্রাপ্যশক্তি, ধারার আণবিক বিশৃঙখলা প্রভৃতি সম্পর্কে জানা যায়৷
এনট্রপির মান যদি ধনাত্মক বা শূন্য অপেক্ষা বেশি হয় তাহলে বোঝা যায়, প্রক্রিয়াটি একাভিমুখী বা স্বতঃস্ফুর্ত।
সহজে বোঝার জন্য ধরুন একটি ফোলানো বেলুন, যেটার তাপশক্তি স্থির অর্থাৎ তাপ প্রবেশও করবেনা আবার তাপ বাহিরেও যাবেনা।
এখন বাহির থেকে চাপ দিয়ে বেলুনটাকে সংকোচিত করা হলে বেলুনের তাপশক্তি একই থাকবে কিন্ত তাপমাত্রা বেড়ে যাবে।
যেহেতু তাপমাত্রা বেড়ে যাবে তাই ফেলুনের ভিতরে থাকা বাতাসের অনুগুলো বেশি ছোটাছোটি করবে। অর্থাৎ বিশৃংঙ্খল হয়ে পড়বে আর এটাই হচ্ছে এন্ট্রপি।
খুব সহজ কথায় রুদ্ধতাতীয় সিস্টেমে তাপমাত্রার প্রভাবে কোনো বস্তুর গোছালো থেকে অগোছালো হবার ঘটনাই এন্ট্রপি।
পরম শূন্য তাপমাত্রা কত
এই মহাবিশ্বের সম্ভাব্য সর্বনিম্ন তাপমাত্রা। তাপমাত্রা মাপক যন্ত্রে এর মান হচ্ছে ০ কেলভিন অথবা -২৭৩.১৫ ডিগ্রি সেলসিয়াস বা –৪৬০ ডিগ্রি (F) ফারেনহাইট। মহাবিশ্বে এর থেকে কম তাপমাত্রা হওয়া সম্ভব নয়।
আরও বিষয়টিকে ক্লিয়ার করার জন্য অন্যভাবে চিন্তা করি,
এন্ট্রপি কি
এন্ট্রপির সবচেয়ে সহজ সংজ্ঞা ধাপে ধাপে এখান থেকে পাওয়া যায় – “বস্তুতে তাপ দিলে যদি তার তাপমাত্রা বাড়ে,
তাহলে প্রতি একক তাপমাত্রায় যতটুকু তাপ বেড়েছে, সেটাই হলো এন্ট্রপির পরির্বতন”। দেখা যাচ্ছে, এন্ট্রপিকে একটা নতুন রকম রাশি চিন্তা করে
তার পরিবর্তন কীভাবে মাপা যায়, তার ব্যাপারে বলা হয়েছে। মাথায় রাখতে হবে, এখানে কেবল এন্ট্রপির কতটুকু পরিবর্তন হয়েছে সেটা বলা হয়েছে।
এন্ট্রপি আসলে নিজেই ব্যাপারটা কী, সেটা এখনো আসেনি। এই সংজ্ঞার পরের অংশেই ব্যাপারটা এসে পড়বে। এন্ট্রপি কি
এনট্রপির পরিবর্তন সূত্র
ধরলাম, ΔQ পরিমাণ তাপ দেওয়ার ফলে বস্তুর তাপমাত্রা T তে গিয়ে পৌঁছায়। তাহলে এন্ট্রপি বাড়লো S পরিমাণ। সাধারণত এন্ট্রপিকে ‘S’ দিয়ে প্রকাশ করা হয়।
তাই এর পরিবর্তনকে লেখা হয় ΔS । সুতরাং,
এখন যদি কোন প্রক্রিয়ায় তাপের পরিবর্তন না হয়, তাহলে ΔQ= 0 , ফলে এন্ট্রপির পরিবর্তন ΔS=0 । এখন, যে প্রক্রিয়ায় তাপের পরিবর্তন হয় না,
অর্থাৎ বাইরে থেকেও তাপ আসে না, আবার ভেতর থেকেও তাপ বের হতে পারে না, এমন প্রক্রিয়াকে বলা হয় রুদ্ধতাপীয় প্রক্রিয়া (রুদ্ধ মানে নিষেধাজ্ঞা, অর্থাৎ আটক অবস্থা।
রুদ্ধতাপীয় মানে তাপের ভেতরে বা বাইরে যাওয়া নিষেধ)।
তাহলে দেখা যাচ্ছে, রুদ্ধতাপীয় প্রক্রিয়ায় এন্ট্রপির কোনো পরিবর্তন হয় না। অর্থাৎ আগে যা ছিলো, তাই থাকে। ঠিক এই জায়গা থেকেই এন্ট্রপির মূল সংজ্ঞাটা দেয়া যায়।
যদি এন্ট্রপি একটা রাশি হয় (ভর, দৈর্ঘ্য, সময় – এগুলোর মত), তাহলে সেটার মান রুদ্ধতাপীয় প্রক্রিয়ায় পরিবর্তিত হয় না, বরং স্থির থাকে।
তাই এন্ট্রপির সংজ্ঞায় উল্টাভাবে বলা হয়, “রুদ্ধতাপীয় প্রক্রিয়ায় কোনো বস্তুর মাঝে তাপের সাথে সম্পর্কিত যে রাশিটির মান স্থির থাকে, তাকেই এন্ট্রপি বলে”।
আবার,
যদি ds হয় এন্ট্রপির পরিবর্তন, তাহলে গাণিতিক সমীকরন দাড়াবে,

আরও পড়ুন:
পদার্থের অবস্থা ও পরিবর্তন
সূত্রটা হল G=H-TS ।
অর্থাৎ dQ = 0।
এখানে একটি প্রশ্ন-
কোনো ঘটনায় এন্ট্রপি হয় স্থির থাকে,আর নাহয় বাড়ে, তবে কখনোই কমেনা।
একটু বুঝিয়ে বলা যাক, মনে করি একগ্লাস পানি যা স্বাভাবিক অবস্থায় স্থির। এখন যত তাপমাত্রা বৃদ্ধি করবো
পানির অনুগুলো ততই কাপতে থাকবে অর্থাৎ স্থির থেকে অস্থির হবে। তাই যত তাপমাত্রা বৃদ্ধি করবো এন্ট্রপি ততই বাড়তে থাকবে।
এবার বিপরীতটা করি, একগ্লাস গরম পানিকে ঠান্ডা করি,যেহেতু গরম থেকে ঠান্ডা করতেছি তাই এক্ষেত্রে পানির
অণুগুলো অস্থির থেকে স্থির হচ্ছে অর্থাৎ পানির এন্ট্রপি কমে যাচ্ছে। এক্ষেত্রে পানির এন্ট্রপি কমে যাচ্ছে ঠিকই কিন্তু
পানি পরিবেশকে সেই তাপ প্রদান করে পরিবেশে থাকা বাতাসের অণুগুলোকে বিশৃঙ্খল করছে। অর্থাৎ পরিবেশের এন্ট্রপি বেড়ে দিচ্ছে।
সুতারাং এ থেকে বোঝা যায় এন্ট্রপি কখনো কমেনা, এন্ট্রপি সবসময় বাড়ে।
এনট্রপির একক
এন্ট্রপির একক হচ্ছে “Joule/K” জুল/কেলভিন।
এন্ট্রপি কি সব বস্তুর ক্ষেত্রে সমান হারে বাড়ে?
না, কঠিন পদার্থে সবচেয়ে কম বাড়ে,তরলে কঠিনের চেয়ে বেশি এবং গ্যাসে সবচেয়ে বেশি।
এনট্রপির মাত্রা
এটা সাধারণত শক্তি/তাপমাত্রার এককে নির্দিষ্ট করা হয়। ভিত্তি মাত্রায় শক্তি হল ভর*দূরত্ব^2/সময়^2। সুতরাং এনট্রপির ভিত্তি মাত্রা হবে ভর*দূরত্ব^2/(তাপমাত্রা*সময়^2)।
এন্ট্রপি শুধু বাড়েই কেন?
ধরি একটুকরা কাঠ, স্বাভাবিক অবস্থায় কাঠের মধ্যে কাঠের অণু গুলো সাজানো গোছানো থাকে, কিন্তু সেই কাঠ যখন আমরা
পোড়াই তখন কাঠের অণু বিশৃঙ্খল হয়, সাথে কাঠ দ্বারা উৎপন্ন তাপশক্তি পরিবেশের এন্ট্রপি বাড়িয়ে দেয়। কিন্তু যদি আমরা কাঠের টুকরাটি কাঠের টুকরার জায়গায় রেখে দিতাম তাহলে এন্ট্রপি কমতো না ঠিকই কিন্ত বাড়তোও না।
আমরা এন্ট্রপি বাড়াই আমাদের জীবনের প্রয়োজনে, অথবা আনন্দ উপভোগ করতে। যেমন খাবার রান্না করতে তাপশক্তি লাগে আর তাপশক্তি মানে এন্ট্রপি বৃদ্ধি। আমরা জানি এন্ট্রপি বাড়বে কিন্তু তবুও আমাদের জীবন ধারনের প্রয়োজনে আমরা এন্ট্রপি বাড়াই। যদিও অনেক ক্ষেত্রে
নিছক আনন্দ উপভোগের জন্য আমরা এন্ট্রপি বাড়াই, যেমন ধুমপান করা।।
এন্ট্রপির তাৎপর্য (Significant of entropy)
তাপগতিবিদ্যায় এট্রপির গুরুত্ব অপরিসীম। এর নিম্নলিখিত তাৎপর্য রয়েছে :
১। এন্ট্রপি একটি প্রাকৃতিক রাশি যার মান তাপ ও পরম তাপমাত্রার অনুপাতের সমান।
২। এটি বস্তুর একটি তাপীয় ধর্ম যা তাপ সঞ্চালনের দিক নির্দেশ করে।
৩। এটি বস্তুর তাপগতীয় অবস্থা নির্ধারণে সহায়তা করে।
৪। এটি তাপমাত্রা, চাপ, আয়তন, অন্তর্নিহিত শক্তি, চুম্বকীয় অবস্থার ন্যায় কোনো বস্তুর অবস্থা প্রকাশ করে।
৫। এন্ট্রপি বৃদ্ধি পেলে বস্তু শৃঙ্খল অবস্থা (ordered state) হতে বিশৃঙ্খল অবস্থায় (disordered state) পরিণত হয়।
৬। তাপমাত্রা ও চাপের ন্যায় একে অনুভব করা যায় না।
এ সম্পর্কিত প্রশ্ন ও উত্তরঃ–
১। কোনো তাপ প্রবাহের সাথে এন্ট্রপি বাড়ে নাকি কমে-?
কারো মনে চিন্তা আসতে পারে, “যদি তাপ দেয়ার ফলে কোনো বস্তুর এন্ট্রপি বাড়ে, তাহলে কোনো বস্তু থেকে তাপ নিলে তো তার এন্ট্রপি কমার কথা!” হ্যাঁ, অবশ্যই কমে।
তাপ দিলে যদি ΔQ কে ধণাত্মক ধরা হয়, তাহলে তাপ বের হয়ে গেলে ΔQ কে ঋণাত্মক ধরতে হবে। তখন তার এন্ট্রপির পরিবর্তন ΔS-ও ঋণাত্মক হবে,
অর্থাৎ এন্ট্রপি কমবে। এখন আসি আরো একটা ব্যাপারে। যে তাপটুকু বের হয়ে গেলো, সেটা নিশ্চয়ই অন্য কোনো বস্তু বা স্থানে গেছে! তাহলে সেই স্থানের
এন্ট্রপি কিন্তু আবার বেড়ে গেলো। তাই আলাদাভাবে যদিও এন্ট্রপি বাড়তে বা কমতে পারে, কিন্তু যদি দুটো বস্তুর মোট এন্ট্রপির পরিবর্তন যোগ করে দেখা হয়,
তাহলে দেখা যাবে মোট পরিবর্তনের মান ধনাত্মক হবে।
খুব সহজ একটা উদাহরণ দিয়ে এটা বুঝা যায়। তাপ সাধারণভাবে বেশি তাপমাত্রার জায়গা থেকে কম তাপমাত্রার জায়গায় প্রবাহিত হয়।
ধরা যাক, T1 তাপমাত্রার গরম জায়গা থেকে ΔQ পরিমাণ তাপ T2 তাপমাত্রার অপেক্ষাকৃত ঠাণ্ডা জায়গায় গেছে। যেহেতু প্রথম গরম জায়গাটি কিছু তাপ হারিয়েছে,
তাই তার এন্ট্রপি কমেছে। একে ΔS1 ধরা হলে,
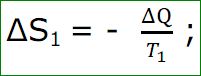
ঋণাত্মক চিহ্ন দেয়া হয়েছে তাপ কমার ব্যাপারটা বুঝানোর জন্য। এখন এই তাপ যেহেতু দ্বিতীয় বস্তু পেয়েছে, তাই তার এন্ট্রপি বেড়েছে। একে ΔS2 ধরা হলে,

সুতরাং পুরো প্রক্রিয়ায় মোট এন্ট্রপির পরিবর্তন = ΔS1 + ΔS2
অর্থাৎ পুরো প্রক্রিয়ায় মোট এন্ট্রপির পরিবর্তনও ধনাত্মক। এখান থেকেই সাধারণ সিদ্ধান্তে আসা যায় যে, তাপের প্রবাহ সম্পর্কিত যেকোনো
ঘটনা ঘটলে সেই প্রবাহের সাথে সম্পর্কিত সবগুলো বস্তুর এন্ট্রপির পরিবর্তন যোগ করলে তার মান ধনাত্মক হবে।
আর যদি তাপের প্রবাহ না থাকে (যেমন রূদ্ধতাপীয় প্রক্রিয়ায়) তাহলে তার পরিবর্তন হবে শূন্য। গাণিতিকভাবে বললে,
যেকোনো প্রক্রিয়ায় ΔS ≥ 0
যেহেতু দেখা যাচ্ছে, কিছু একটা ঘটলেই তার সাথে যুক্ত থাকা মোট এন্ট্রপির পরিবর্তনের মান কোনোমতেই কমানো যাবে না,
তাই ব্যাপারটা নিয়ন্ত্রণের কোন সুযোগ নেই। অর্থাৎ ব্যাপারটা আমাদের হাতের বাইরে, বা শৃঙ্খলিত না। সেজন্যই একে বিশৃঙ্খলার পরিমাপক হিসেবে ধরা হয়।
২। জগতের তাপীয় মৃত্যু কি?
উত্তর : প্রকৃতিতে সবকিছুই সাম্যাবস্থা পেতে চেষ্টা করে। একটি সিস্টেম যতই সাম্যাবস্থার দিকে এগিয়ে যায় ততই তার কাছ থেকে কাজ পাওয়ার সম্ভাবনা কমে যায়,
সাম্যাবস্থায় পৌঁছলে সিস্টেম থেকে আর কোনো কাজই পাওয়া যাবে না। সিস্টেমের এই শক্তির রূপান্তরের অক্ষমতা বা অসম্ভাব্যতাই হচ্ছে এনট্রপি।
এক বা একাধিক সিস্টেম যত সাম্যাবস্থার দিকে এগিয়ে যায় তাদের এনট্রপিও তত বাড়তে থাকে। সাম্যাবস্থায় এনট্রপি সবচেয়ে বেশি হয়।
যেহেতু প্রকৃতিতে সবকিছুই সাম্যাবস্থা পেতে চায়,
তাই বলা যায় যে, জগতে এনট্রপি ক্রমাগত বাড়ছে। জগতের এনট্রপি যখন সর্বোচ্চে পৌছাবে তখন সব কিছুর তাপমাত্রা এক হয়ে যাবে।
ফলে তাপশক্তিকে আর যান্ত্রিক শক্তিতে রূপান্তরিত করা যাবে না।
এই অবস্থাকে জগতের তথাকথিত তাপীয় মৃত্যু (Heat death of the universe) নামে অভিহিত করা হয়েছে।
৩. মহাবিশ্বের এনট্রপি কত?
বর্তমানে মহাবিশ্বের এনট্রপি হচ্ছে 10^101 । এখন পর্যন্ত জানা মতে মহাবিশ্বের এনট্রপি সর্বাধিক হবে 10^120 ।
৪. পৃথিবীর এনট্রপি দিন দিন বৃদ্ধি পাচ্ছে ব্যাখ্যা কর
এই জগতের সব কিছুই সাম্য অবস্থা পেতে চায়। এতে করে সব বস্তুরই এনট্রপি দিনদিন বাড়ছে।
সার্বিক অর্থে জগতের এনট্রপি দিনদিন বাড়ছে। এনট্রপি বাড়া মানে তাপমাত্রা বাড়ছে। তাই বলা যায় জগতের সব কিছুর তাপমাত্রা বাড়ছে।
আমাদের পৃথিবীর প্রায় সব সিস্টেমই অপ্রতাবর্তী, তাই পৃথিবীর এনট্রপি বেড়েই চলেছে। এভাবে দেখা যায় আজ যেখানে
৩০ ডিগ্রী সেলসিয়াস তাপমাত্রায় কাজ হয়, পরবর্তী শতকে কাজ করতে হলে হয়তো তাপমাত্রা ৩০ ডিগ্রী সেলসিয়াস কিছুটা বাড়াতে হবে।





