পদার্থের প্রকারভেদ
পদার্থের প্রকারভেদ: আমাদের চারপাশে অসংখ্য জিনিস আছে। যেমনঃ বাড়ি-ঘর, গাছ-পালা, মাটি, পানি, কাঁচ, লোহা প্রভৃতি। এর সব কিছুই পদার্থের তৈরী। সহজভাবে বলতে এই বিশ্বব্রহ্মাণ্ডের সবই পদার্থের তৈরী। তাহলে পদার্থ কি?
সাধারণত যা কিছুর ভর আছে তাই পদার্থ। এই ভর থাকায় পদার্থের কিছু মৌলিক বৈশিষ্টের সৃষ্টি হয়। সেগুলোকে উপরের সংজ্ঞার সাথে জুড়ে দিলেই পাওয়া যায় পদার্থের সর্বজন গৃহীত সংজ্ঞা। তা হচ্ছে-
“যার ভর আছে, জায়গা দখল করে ও জড়তা আছে- অর্থাৎ বল প্রয়োগে বাধার সৃষ্টি করে তাকে পদার্থ বলে।”
পদার্থকে ভৌত অবস্থার এবং রাসায়নিক গঠনের উপর ভিত্তি করে বিভিন্ন ভাগে ভাগ করা যায়।
সাধারণ পরিবেশে ভৌত অবস্থাভেদে পদার্থ আমরা প্রধানত তিনটি অবস্থায় পাই। যথা- কঠিন, তরল এবং বায়বীয়। নিচে এদের সম্পর্কে বিস্তারিত লেখা হলো।
পদার্থ কত প্রকার
- ১. কঠিন পদার্থ(Solid Matter)
- ২. তরল পদার্থ(Liquid Matter)
- ৩. বায়বীয় পদার্থ(Gaseous Matter)
কঠিন পদার্থ কি
যে পদার্থের নির্দিষ্ট আকার এবং আয়তন আছে তাকে কঠিন পদার্থ বলে। কঠিন পদার্থে কণা বা অণুগুলোর আন্তঃআণবিক শক্তি খুব বেশি থাকে এবং আন্তঃআণবিক দূরত্বও অপেক্ষাকৃত অন্য দুই অবস্থার থেকে অনেক কম।
যেমন: সোনা, রূপা, তামা, পাথর, কাঠ, বালি, লবণ ইত্যাদি (পদার্থের প্রকারভেদ)
কঠিন পদার্থের বৈশিষ্ট্য:
(1) নির্দিষ্ট চাপ ও তাপমাত্রায় কঠিন পদার্থের নির্দিষ্ট আকার বা আয়তন থাকে।
(3) কঠিন পদার্থের নির্দিষ্ট গলনাঙ্ক ও স্ফুটনাঙ্ক আছে।
(4) কঠিন পদার্থ প্রবাহিত হতে পারে না অর্থাৎ এদের প্রবাহী ধর্ম নেই।
(5) কঠিন পদার্থে তাপ প্রয়োগ করলে, পদার্থটি একসময় তরলে পরিণত হয়।
(6) সাধারণ অবস্থায় বাইরে থেকে কোনো শক্তি প্রয়োগ না করলে, কঠিন পদার্থের আকার বা আয়তনের কোনো পরিবর্তন হয় না।
(7) কঠিন পদার্থের প্রচন্ড উপর চাপ প্রয়োগ করলেও কঠিন পদার্থের আয়তন পরিবর্তন প্রায় হয় না।
(8) সাধারণ তাপমাত্রায় কঠিন পদার্থ গ্যাসের মতো ছড়িয়ে পড়ে না অর্থাৎ বাষ্পায়ন হয় না। কিন্তু কর্পূর, ন্যাপথ্যালিন, নিশাদল এরা কঠিন হলেও সাধারণ তাপমাত্রায় বাষ্পে পরিনত হয়। একে ঊর্দ্ধপাতন বলে।
(9) সাধারণ চাপ ও তাপমাত্রায় কতকগুলি কঠিন পদার্থ কেলাসাকার হয় যেমন, বরফ, তুঁতে, সাধারণ লবন, ফটকিরি। আবার কিছু কঠিন পদার্থ অকেলাসাকার হয় যেমন, কাঁচ, চক, পিচ ইত্যাদি
তরল কাকে বলে
যে ভৌত অবস্থায় পদার্থ নির্দিষ্ট আয়তন প্রদর্শন করে কিন্তু নির্দিষ্ট আকার থাকে না। যে পাত্রে রাখা হয় তার আকার ধারণ করে, তাকে তরল পদার্থ বলে। এই পদার্থের অণুগুলো পরস্পরের সাথে শিথিল আন্তঃআণবিক শক্তির মাধ্যমে আবদ্ধ থাকে। তাই তারা নির্দিষ্ট আকার বা আকৃতি প্রদর্শন করে না। (পদার্থের প্রকারভেদ)
যেমন: জল, দুধ, অ্যালকোহল ইত্যাদি
তরল পদার্থের বৈশিষ্ট্য
(1) নির্দিষ্ট চাপ ও তাপমাত্রায় তরল পদার্থের একটি নির্দিষ্ট আয়তন আছে কিন্তু কোনো নির্দিষ্ট আকার নেই। যে পাত্রে তরলকে ঢালা হয়, সেই পাত্রের আকার ধারণ করে।
(2) তরল পদার্থের নির্দিষ্ট হিমাঙ্ক ও স্ফুটনাঙ্ক আছে।
(3) তরল পদার্থ প্রবাহিত হতে পারে অর্থাৎ এদের প্রবাহী ধর্ম আছে।
(4) তরল পদার্থকে তাপ প্রয়োগ করলে একটি নির্দিষ্ট তাপমাত্রায় গ্যাসীয় পদার্থে পরিণত হয়।
(5) তরল পদার্থের উপর প্রচন্ড চাপ প্রয়োগ করলে তরল পদার্থের আয়তন সামান্য কমে।
(6) সাধারন তাপমাত্রায় তরলের উপরিতল থেকে সবসময় বাষ্পায়ন হয়।
(7) তরলের তাপমাত্রা কমাতে থাকলে একটি নির্দিষ্ট তাপমাত্রায় ওই তরল কঠিন পদার্থে পরিণত হয়।
(8) কোনো পাত্রে তরল রাখলে স্থির অবস্থায় তরলের উপরিতল সর্বদা অনুভূমিক হয়। (পদার্থের প্রকারভেদ)
পানিকে আমরা যদি বোতলে রাখি তবে তা বোতলের মতই আকার নেয়, যদি বালতিতে রাখি তবে নেয় বালতির আকার। সকল তরলের জন্যই এই বৈশিষ্ট্য একই।
বায়বীয় পদার্থ কাকে বলে
– বায়বীয় বা গ্যাসীয় পদার্থে আন্তঃআণবিক শক্তি প্রায় থাকে না বললেই চলে। থাকলেও তা খুবই দূর্বল। তাই এর অণুগুলো প্রায় স্বাধীন ভাবে এবং দ্রুত নড়াচড়া করতে পারে। এজন্য বায়বীয় পদার্থের নির্দিষ্ট আকার তো নেইই, সেইসাথে এর কোন নির্দিষ্ট আয়তনও থাকে না। যে পাত্রেই রাখা হোক না কেন, সেই পাত্রেরই পুরো আয়তন জুড়ে বিরাজ করে। সুতরাং বলা যায় যে-
যে ভৌত অবস্থায় কোন পদার্থের নির্দিষ্ট আকার বা আয়তন থাকে না তাকেই বায়বীয় পদার্থ বলে।
যেমন: অক্সিজেন, বায়ু, হাইড্রোজেন, জলীয় বাষ্প, কার্বন ডাইঅক্সাইড ইত্যাদি
গ্যাসীয় পদার্থের বৈশিষ্ট্য
(1) গ্যাসীয় পদার্থের নির্দিষ্ট আকার বা আয়তন নেই।
(2) গ্যাসীয় পদার্থের পরিমাণ যতই কম হোক না কেন, যে পাত্রে রাখা হয় সেই পাত্রের আকার ও সমস্ত আয়তন দখল করে।
(3) গ্যাসীয় পদার্থের নির্দিষ্ট কোনো গলনাঙ্ক, হিমাঙ্ক, স্ফুটনাঙ্ক কিছুই নেই
(4) গ্যাসীয় পদার্থ প্রবাহিত হতে পারে অর্থাৎ এদের প্রবাহী ধর্ম আছে।
(5) গ্যাসীয় পদার্থে তাপমাত্রা বাড়ালে এদের অণুগুলির গতিশক্তি বেড়ে যায়।
এখানে উল্লেখ্য যে, পদার্থের ভৌত অবস্থা তাপ এবং চাপের উপর নির্ভর করে। তাই তাপ বা চাপ প্রয়োগ অথবা অপসারণের মাধ্যমে প্রতিটি পদার্থকে এক অবস্থা থেকে অন্য অবস্থায় রূপান্তরিত করা যায়। যেমনঃ সাধারণ তাপমাত্রায় পানি তরল হিসেবে থাকে। তাকে আমরা রেফ্রিজারেটরে ঠান্ডা করলে বরফ পাই- যা কঠিন পদার্থ। আবার চুলায় রেখে ফুটালে তা গ্যাস বা বায়বীয় আকার ধারণ করে। পদার্থের এই পরিবর্তন সচরাচর কঠিন থেকে তরল এবং তরল থেকে বায়বীয়- এভাবে অথবা তার বিপরীত ভাবে হয়। কিন্তু কিছু কিছু পদার্থ আছে যারা কঠিন থেকে তরল না হয়ে সরাসরি বায়বীয় পদার্থে পরিণত হয়। এদের উদ্বায়ী পদার্থ বলে। যেমনঃ ন্যাপথলিন, কর্পুর।
আবার কঠিন, তরল বা বায়বীয় অবস্থা ছাড়াও পদার্থ আরো দুটি ভৌত অবস্থা আছে যদিও সাধারণভাবে সেগুলোকে আমরা দেখতে পাই না। সেগুলোর একটা প্লাজমা, সহজ করে বললে, উচ্চ তাপমাত্রায় পদার্থের গ্যাসীয় অবস্থা। অগ্নি শিখার উপরের গ্যাসীয় পদার্থ হল প্লাজমা, যার পরমাণু থেকে এক বা একাধিক ইলেকট্রন বিচ্ছিন্ন হয়ে গিয়েছে।
আরও পড়ুন : পদার্থের অবস্থা ও পরিবর্তন
রসায়নবিদ্যায় পদার্থকে প্রধান দুইটি শ্রেণিতে ভাগ করা হয়। যথাঃ মৌলিক পদার্থ এবং যৌগিক পদার্থ।
১। মৌলিক পদার্থঃ যে পদার্থকে ক্ষুদ্র ক্ষুদ্র অংশে ভাগ করলে ওই পদার্থ ছাড়া অন্য কোনো পদার্থ পাওয়া যায় না, তা-ই মৌলিক পদার্থ।যে পদার্থকে রাসায়নিক পদ্ধতিতে বিভাজিত করে দুই বা ততোধিক ভিন্ন ধর্মবিশিষ্ট পদার্থে বিশ্লিষ্ট করা যায় না, অর্থাৎ যে পদার্থ হতে সাধারণভাবে সেই পদার্থ ব্যতীত অন্য কোন নূতন পদার্থ পাওয়া যায় না, তাকে মৌল বা মৌলিক পদার্থ বলে। যেমনঃ হাইড্রোজেন (H2), সোডিয়াম (Na)। হাইড্রোজেনকে যত ভাগে ভাগ করা হোক- হাইড্রোজেনই পাওয়া যাবে। একইভাবে সোডিয়ামকে ভাগ করলেও শুধু সোডিয়ামই পাওয়া যায়।
২। যৌগিক পদার্থঃ যে পদার্থ থেকে দুই বা ততোধিক সম্পূর্ণ ভিন্ন ধর্মবিশিষ্ট মৌলিক পদার্থ পাওয়া যায়, সেই পদার্থকে যৌগ বা যৌগিক পদার্থ বলে। যেমনঃ যেমন : খাবার লবণ বা সোডিয়াম ক্লোরাইড (NaCl)
এখানে সোডিয়াম ক্লোরাইডকে ভাগ করলে সোডিয়াম (Na) ও ক্লোরিন (Cl) পাওয়া যাবে।
এছাড়াও রসায়নবিদ্যায় মিশ্রণ বা মিশ্র পদার্থ হিসেবে পদার্থের একটি রূপ প্রকাশ করা হয়। দুই বা তার অধিক মৌলিক অথবা যৌগিক পদার্থের ভৌত সমবায়ে গঠিত পদার্থকে বোঝায়। মিশ্র পদার্থের পদার্থগুলি কোন রাসায়নিক বন্ধন বা অন্যকোন রাসায়নিক পরিবর্তন ছাড়াই অর্থাৎ যার যার গঠন ও ধর্ম বজায় রেখে যান্ত্রিকভাবে মিশ্রিত থাকে। যেমনঃ বাতাস- এতে অক্সিজেন, নাইট্রোজেন, কার্বন-ডাই-অক্সাইড সহ আরো অনেক পদার্থ নিজ নিজ গুণ বজায় রেখে বর্তমান।
কঠিন, তরল ও গ্যাসীয় পদার্থের পার্থক্য:
| কঠিন পদার্থ | তরল পদার্থ | গ্যাসীয় পদার্থ |
|---|---|---|
| (1) কঠিন পদার্থের নির্দিষ্ট আকার ও আয়তন আছে। | (1) তরল পদার্থের কোনো নির্দিষ্ট আয়তন আছে কিন্তু নির্দিষ্ট আকার নেই, যে পাত্রে রাখা হয় সেই পাত্রের আকার ধারণ করে। | (1) গ্যাসীয় পদার্থের কোনো নির্দিষ্ট আকার বা আয়তন কোনোটাই নেই, যে পাত্রে রাখা হয় তার আকার ও আয়তন দখল করে। |
| (2) কঠিন পদার্থের নির্দিষ্ট গলনাঙ্ক ও স্ফুটনাঙ্ক আছে। | (2) তরল পদার্থের নির্দিষ্ট হিমাঙ্ক ও স্ফুটনাঙ্ক আছে। | (2) গ্যাসীয় পদার্থের নির্দিষ্ট কোনো গলনাঙ্ক, হিমাঙ্ক বা স্ফুটনাঙ্ক কিছুই নেই। |
| (3) কঠিন পদার্থের উপর অনেক চাপ প্রয়োগ করে এর আয়তন প্রায় পরিবর্তন ঘটানো যায় না। | (3) তরল পদার্থের উপর অনেক চাপ প্রয়োগ করে এর আয়তন সামান্য পরিবর্তন ঘটানো যায়। | (3) গ্যাসীয় পদার্থের উপর অনেক চাপ প্রয়োগ করে এর আয়তন অনেক পরিবর্তন ঘটানো যায়। |
| (4) কঠিন পদার্থ প্রবাহিত হতে পারে না। তাই কঠিন পদার্থ প্রবাহী নয়। | (4) তরল পদার্থ প্রবাহিত হতে পারে। তাই তরল পদার্থ প্রবাহী। | (4) গ্যাসীয় পদার্থ প্রবাহিত হতে পারে। তাই গ্যাসীয় পদার্থ প্রবাহী। |
যেকোনও পদার্থের মধ্য উপস্থিত উপাদানগুলির প্রকৃতি ওপর নির্ভর করে পদার্থগুলিকে আবার দুইভাগে ভাগ করা হয়।
(1) বিশুদ্ধ পদার্থ
(2) মিশ্র পদার্থ
এই বিশুদ্ধ পদার্থ আবার দুইরকম হতে পারে:
(1) মৌলিক পদার্থ
(2) যৌগিক পদার্থ
এবং মিশ্র পদার্থ আবার দুই ধরণের হতে পারে:
(1) সমসত্ত্ব মিশ্র পদার্থ
(2) অসমসত্ত্ব মিশ্র পদার্থ
বিশুদ্ধ পদার্থ: যে সমস্ত পদার্থ শুধুমাত্র একটি পদার্থেরই দ্বারা গঠিত, অন্য কোনও পদার্থের উপাদান মিশে থাকে না, তাদের বিশুদ্ধ পদার্থ বলে।
যেমন: বিশুদ্ধ জল, লোহা, সোনা, তামা, বিশুদ্ধ নাইট্রোজেন ইত্যাদি
এই বিশুদ্ধ পদার্থ আবার দুই ধরণের হতে পারে।
(1) মৌলিক পদার্থ
(2) যৌগিক পদার্থ
মৌলিক পদার্থ: যে পদার্থকে বিশ্লেষণ করলে ওই পদার্থের উপাদান কণিকা ছাড়া অন্য কোনো পৃথক ধর্মের পদার্থের উপাদান কণিকা পাওয়া যায় না, তাদের মৌলিক পদার্থ বলে।
পৃথিবীতে মৌলিক পদার্থের সংখ্যা 105 টি। এদের মধ্যে স্বাভাবিক অবস্থায় কতকগুলি পদার্থ কঠিন, কতকগুলি পদার্থ তরল এবং কতকগুলি পদার্থ গ্যাসীয় হয়।
যেমন:
কঠিন মৌলিক পদার্থ: সোনা, রূপা, তামা, দস্তা, গন্ধক, সীসা, কার্বন ইত্যাদি
তরল মৌলিক পদার্থ: পারদ, ব্রোমিন ইত্যাদি
গ্যাসীয় মৌলিক পদার্থ: হাইড্রোজেন, অক্সিজেন, নাইট্রোজেন, ক্লোরিন, আর্গন ইত্যাদি। সোনা, রূপা, তামা ইত্যাদি
যৌগিক পদার্থ: দুই বা ততোধিক মৌলিক পদার্থের উপাদান কণিকা, নির্দিষ্ট ওজন অণুপাতে পরস্পর রাসায়নিক বিক্রিয়া দ্বারা যুক্ত হয়ে যে ভিন্ন ধর্মের পদার্থ উৎপন্ন করে, তাকে যৌগিক পদার্থ বলে।
যেমন: জল, কার্বন ডাই অক্সাইড, সাধারণ লবণ ইত্যাদি (পদার্থের প্রকারভেদ)
মিশ্র পদার্থ: দুই বা ততোধিক মৌলিক বা যৌগিক পদার্থকে যেকোনো ওজন অনুপাতে মিশিয়ে যদি এমন পদার্থ পাওয়া যায় যাতে, মিশ্রিত ভিন্ন ভিন্ন পদার্থগুলি তাদের নিজেদের ধর্ম বজায় রাখে, তবে সেই পদার্থকে মিশ্র পদার্থ বলে।
যেমন:
বায়ু: অক্সিজেন, কার্বন ডাইঅক্সাইড, নাইট্রোজেন ও জলীয় বাষ্পের মিশ্রন
শরবত: লবন, চিনি ও জলের মিশ্রন।
বারুদ: পটাশিয়াম নাইট্রেট, সালফার ও কাঠকয়লার মিশ্রন।
ধোঁয়া: বায়ু ও কার্বনের সূক্ষ মিশ্রন।
সোডা ওয়াটার: কার্বন ডাইঅক্সাইড ও জলের মিশ্রন।
পিতল: তামা ও জিঙ্কের মিশ্রন।
কাঁসা: তামা ও টিনের মিশ্রন।
মিশ্র পদার্থের বৈশিষ্ট্য:
(1) মিশ্র পদার্থে উপাদান কণাগুলি পাশাপাশি থাকে।
(2) মিশ্র পদার্থে উপাদান কণাগুলির ধর্মের কোনো পরিবর্তন হয় না।
(3) খুব সহজেই মিশ্র পদার্থ থেকে উপাদান কনাগুলিকে আলাদা করা যায়।
(4) যেকোনো ওজন অনুপাতে দুই বা ততোধিক পদার্থ মেশালেই মিশ্র পদার্থ তৈরি হয়।
(5) মিশ্র পদার্থের কোনো নির্দিষ্ট গলনাঙ্ক বা স্ফটনাঙ্ক থাকে না।
(6) মিশ্রন সাধারণত অসমসত্ত্ব হয় তবে ব্যতিক্রম হল দ্রবণ যেখানে দ্রবণ হল একটি সমসত্ত্ব মিশ্র পদার্থ।
এই মিশ্র পদার্থ আবার দুইধরণের হয়।
(1) সমসত্ত্ব মিশ্র পদার্থ: এই ধরণের মিশ্র পদার্থে, পদার্থের প্রতিটা অংশের ভৌতধর্ম, প্রকৃতি সর্বদা সমান হয়।
যেমন: জলে চিনির দ্রবন, জলে লবনের দ্রবন ইত্যাদি
(2) অসমসত্ত্ব মিশ্র পদার্থ: এই ধরণের মিশ্র পদার্থে, পদার্থের প্রতিটা অংশের ভৌতধর্ম, প্রকৃতি আলাদা আলাদা হয়।
যেমন: জল ও কাদার মিশ্রন, বালি ও লোহাচূরের মিশ্রণ (পদার্থের প্রকারভেদ)
আরও পড়ুন : বাংলা সম্পর্কে বিসিএস সম্পূর্ণ প্রস্তুতি দেখুন
মৌলিক পদার্থ ও মিশ্র পদার্থের পার্থক্য:
| মৌলিক পদার্থ | মিশ্র পদার্থ |
|---|---|
| (1) যে পদার্থকে বিশ্লেষণ করলে ওই পদার্থের উপাদান কণিকা ছাড়া অন্য কোনো পৃথক ধর্মের পদার্থের উপাদান কণিকা পাওয়া যায় না, তাদের মৌলিক পদার্থ বলে। | (1) দুই বা ততোধিক মৌলিক বা যৌগিক পদার্থকে যেকোনো ওজন অনুপাতে মিশিয়ে যদি এমন পদার্থ পাওয়া যায় যাতে, মিশ্রিত ভিন্ন ভিন্ন পদার্থগুলি তাদের নিজেদের ধর্ম বজায় রাখে, তবে সেই পদার্থকে মিশ্র পদার্থ বলে। |
| (2) মৌলিক পদার্থ সহজে তৈরি করা যায় না। | (2) মিশ্র পদার্থ যে কোনো সহজ প্রক্রিয়ার মাধ্যমেই তৈরি করা যায়। |
| (3) মৌলিক পদার্থের নির্দিষ্ট গলনাঙ্ক ও স্ফুটনাঙ্ক আছে। | (3) মিশ্র পদার্থের নির্দিষ্ট গলনাঙ্ক ও স্ফুটনাঙ্ক নেই। |
| (4) মৌলিক পদার্থ একই রকম উপাদান কণিকা দ্বারা গঠিত। | (4) মিশ্র পদার্থ বিভিন্ন রকম উপাদান কণিকা দ্বারা গঠিত। |
যৌগিক পদার্থ ও মিশ্র পদার্থের পার্থক্য:
| যৌগিক পদার্থ | মিশ্র পদার্থ |
|---|---|
| (1) দুই বা ততোধিক মৌলিক পদার্থের উপাদান কণিকা, নির্দিষ্ট ওজন অণুপাতে পরস্পর রাসায়নিক বিক্রিয়া দ্বারা যুক্ত হয়ে যে ভিন্ন ধর্মের পদার্থ উৎপন্ন করে, তাকে যৌগিক পদার্থ বলে। | (1) দুই বা ততোধিক মৌলিক বা যৌগিক পদার্থকে যেকোনো ওজন অনুপাতে মিশিয়ে যদি এমন পদার্থ পাওয়া যায় যাতে, মিশ্রিত ভিন্ন ভিন্ন পদার্থগুলি তাদের নিজেদের ধর্ম বজায় রাখে, তবে সেই পদার্থকে মিশ্র পদার্থ বলে। |
| (2) যৌগিক পদার্থে উপাদানগুলি পরষ্পর রাসায়নিকভাবে যুক্ত হয়ে অন্য পদার্থ উৎপন্ন করে। | (2) মিশ্র পদার্থে উপাদানগুলি পাশাপাশি অবস্থান করে। |
| (2) যৌগিক পদার্থ সর্বদা সমসত্ত্ব হবেই। | (2) মিশ্র পদার্থ সমসত্ত্ব বা অসমসত্ত্ব দুইই হতে পারে। |
| (3) যৌগিক পদার্থে মৌলিক উপাদানগুলি নির্দিষ্ট ওজন অনুপাতে যুক্ত হয়ে গঠিত হয়। | (3) মিশ্র পদার্থে মৌলিক উপাদানগুলি যেকোনো ওজন অনুপাতে যুক্ত হয়ে গঠিত হয়। |
| (4) যৌগিক পদার্থে থাকা উপাদানগুলির রাসায়নিক ধর্মের পরিবর্তন ঘটে নতুন পদার্থে পরিণত হয়। | (4) মিশ্র পদার্থে থাকা উপাদানগুলির নিজের নিজের ধর্মের কোনো পরিবর্তন হয় না। |
| (5) যৌগিক পদার্থ উৎপন্নের সময় তাপের বর্জন বা শোষন হবেই। | (5) মিশ্র পদার্থ উৎপন্নের সময় তাপের বর্জন বা শোষন হয় না। |
| (6) যৌগিক পদার্থের উপাদানগুলিকে খুব সহজ উপায়ে পৃথক করা যায় না। | (6) মিশ্র পদার্থের উপাদানগুলিকে খুব সহজ উপায়ে পৃথক করা যায়। |
মৌলিক ও যৌগিক পদার্থের পার্থক্য:
| মৌলিক পদার্থ | যৌগিক পদার্থ |
|---|---|
| (1) যে পদার্থকে বিশ্লেষণ করলে ওই পদার্থের উপাদান কণিকা ছাড়া অন্য কোনো পৃথক ধর্মের পদার্থের উপাদান কণিকা পাওয়া যায় না, তাদের মৌলিক পদার্থ বলে। | (1) দুই বা ততোধিক মৌলিক পদার্থের উপাদান কণিকা, নির্দিষ্ট ওজন অণুপাতে পরস্পর রাসায়নিক বিক্রিয়া দ্বারা যুক্ত হয়ে যে ভিন্ন ধর্মের পদার্থ উৎপন্ন করে, তাকে যৌগিক পদার্থ বলে। |
| (2) মৌলিক পদার্থের পরমাণুগুলির প্রতিটির ভর এবং ধর্ম একই। | (2) যৌগিক পদার্থের গঠনকারী পরমাণুগুলির ভর, ধর্ম সব আলাদা হয়। |
| (3) প্রকৃতিতে মৌলিক পদার্থের সংখ্যা 112 টি, এর মধ্যে 92 টি মৌল প্রাকৃতিক এবং 20 টি মৌলকে কৃত্রিমভাবে তৈরি করা হয়েছে। | (3) প্রকৃতিতে যৌগিক পদার্থের সংখ্যা অনেক। বর্তমানে ওই সংখ্যা প্রায় 11 লক্ষেরও বেশী। |
| (4) মৌলিক পদার্থে, মৌলের অণু একই প্রকার পরমাণু দ্বারা গঠিত। | (4) যৌগিক পদার্থে, যৌগের অণু বিভিন্ন প্রকার পরমাণু দ্বারা গঠিত। |
| (5) মৌলিক পদার্থের বহুরূপতা ধর্ম আছে। | (5) যৌগিক পদার্থের বহুরূপতা ধর্ম নেই। |
| (6) মৌলিক পদার্থকে বিশ্লেষন করলে পৃথক ধর্মের কোনো পদার্থ পাওয়া যায় না। | (6) যৌগিক পদার্থকে বিশ্লেষন করলে পৃথক ধর্মের পদার্থ পাওয়া যায়। |
বিশুদ্ধ মৌলিক পদার্থ আবার চার ধরণের হয়:
ধাতু: যে মৌল সাধারণ অবস্থায় কঠিন, উজ্জ্বল ও চক্চকে, ওজনে ভারী, যাকে আঘাত করলে ধাতব শব্দ উৎপন্ন হয়, যা সাধারণত তাপ ও তড়িতের সুপরিবাহী এবং যা সর্বদা ধনাত্বক তড়িৎধর্মী, তাদের ধাতু বলে।
যেমন: সোডিয়াম, ক্যালশিয়াম, তামা (কপার), লোহা (আয়রণ), অ্যালুমিনিয়াম, রূপা (সিলভার), সোনা (গোল্ড), দস্তা (জিঙ্ক), টিন ইত্যাদি
অধাতু: যে মৌল সাধারণ অবস্থায় তরল বা গ্যাসীয়, উজ্জ্বল বা চক্চকে নয়, ওজনে হালকা, গঠনে ভঙ্গুর, যাকে আঘাত করলে শব্দ উৎপন্ন হয় না, যা সাধারণত তাপ ও তড়িতের কুপরিবাহী এবং যা সর্বদা তড়িৎ ঋনাত্বক, তাদের অধাতু বলে।
যেমন: অক্সিজেন, নাইট্রোজেন, ক্লোরিন, সালফার (গন্ধক), কার্বন, ফসফরাস ইত্যাদি
ধাতুকল্প: যে সমস্ত মৌলের মধ্যে ধাতু ও অধাতু উভয়ের ধর্মই আছে, তাদের ধাতুকল্প বলে।
যেমন: আর্সেনিক, অ্যান্টিমনি
নিষ্ক্রিয় মৌল: যে সমস্ত মৌল কোনও রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না, তাদের নিষ্ক্রিয় মৌল বলে।
যেমন: হিলিয়াম, নিয়ন, আর্গন, ক্রিপটন, জেনন, রেডন ইত্যাদি
ধাতু ও অধাতুদের কিছু ব্যতিক্রম:
ধাতুর ব্যাতিক্রম
সাধারণ তাপমাত্রায় তরল ধাতু: পারদ
ওজনে হালকা ধাতু: সোডিয়াম, লিথিয়াম, পটাশিয়াম
হাইড্রোজেনের চেয়েও কম তড়িৎধনাত্বক ধাতু: তামা, সোনা, রূপা
অধাতুর ব্যাতিক্রম
সাধারণ তাপমাত্রায় তরল অধাতু: ব্রোমিন
সাধারণ তাপমাত্রায় কঠিন ও উজ্জ্বল অধাতু: আয়োডিন, হীরক
তড়িৎ ধনাত্বক অধাতু: হাইড্রোজেন
তড়িৎ পরিবহন করে এমন অধাতু: গ্রাফাইট, গ্যাসকার্বন
গলনাঙ্ক ও স্ফুটনাঙ্ক বেশি এমন অধাতু: কার্বন, বোরন, সিলিকন
ওজনে ভারী এমন অধাতু: আয়োডিন (পদার্থের প্রকারভেদ)
ধাতু ও অধাতুর পার্থক্য
| ধাতু | অধাতু |
|---|---|
| (1) ধাতু সাধারণ অবস্থায় কঠিন, উজ্জ্বল, চক্চকে, তবে ব্যাতিক্রম হিসাবে পারদ ধাতু হলেও তরল। | (1) অধাতু সাধারণ অবস্থায় তরল বা গ্যাসীয় হয় এবং অনুজ্জ্বল, তবে ব্যাতিক্রম হিসাবে আয়োডিন অধাতু হলেও কঠিন। |
| (2) ধাতু প্রসারণশীল এবং ওজনে ভারী ও আঘাত করলে ধাতব শব্দ উৎপন্ন হয়। | (2) অধাতু প্রসারণশীল নয়, হালকা এবং আঘাত করতে শব্দ উৎপন্ন হয় না। |
| (3) ধাতু সাধারণত ধনাত্বক তড়িৎধর্মী। | (3) অধাতু সাধারণত ঋনাত্বক তড়িৎধর্মী, তবে ব্যাতিক্রম হিসাবে হাইড্রোজেন অধাতু হলেও তড়িৎধনাত্বক। |
| (4) ধাতুর গলনাঙ্ক ও স্ফুটনাঙ্ক সাধারণত কম হয়। | (4) অধাতুর গলনাঙ্ক ও স্ফুটনাঙ্ক সাধারণত কম হয়। |
| (5) ধাতুগুলি তাপ ও তড়িতের সুপরিবাহী। | (5) অধাতুগুলি তাপ ও তড়িতের কুপরিবাহী, তবে ব্যাতিক্রম হিসাবে গ্রাফাইট, গ্যাসকার্বন অধাতু হলেও তড়িৎ পরিবহন করে। |
| (6) ধাতুগুলি অক্সিজেনের সাথে বিক্রিয়া করে ক্ষারীয় অক্সাইড গঠন করে। | (6) অধাতুগুলি অক্সিজেনের সাথে বিক্রিয়া করে আম্লিক অক্সাইড গঠন করে। |
পদার্থের গঠন
আমাদের আশপাশে যা দেখি এবং যা কিছুর ভর আছে তাকে পদার্থ বলে। একটি মাত্র উপাদান দিয়ে তৈরি হয় মৌলিক পদার্থ এবং একাধিক মৌলিক পদার্থের সমন্বয়ে তৈরি হয় যৌগিক পদার্থ
কিছু পদার্থ কঠিন, কিছু তরল। আর আছে গ্যাসীয় পদার্থ। বিভিন্ন পদার্থের প্রকৃতি ও গঠন বিভিন্ন রকম হলেও সবই মূলত কয়েকটি অত্যন্ত ক্ষুদ্র কণা দিয়ে তৈরি। এসব কণাকে বলে পরমাণু। পরমাণুগুলোর ভেতর ইলেকট্রন, প্রোটন ও নিউট্রন পাওয়া যায়। একটি অণুর প্রতিটি পরমাণুতে সমান সংখ্যক ইলেকট্রন ও প্রোটন থাকে। প্রতিটি মৌলের পরমাণুর ভেতরকার প্রোটন সংখ্যা আলাদা।
গুরুত্বপূর্ণ তথ্য
অ্যাটম শব্দটি গ্রিক শব্দ অ্যাটমস থেকে নেওয়া হয়েছে। মানে হলো অবিভাজ্য, যাকে ভাগ করা যায় না।
ডেমোক্রিটাসের মতবাদের সঙ্গে দ্বিমত পোষণ করেন প্লেটো ও অ্যারিস্টটল।
ডাল্টন পরমাণু মতবাদ দেন ১৮০৩ সালে।
আধুনিক পরমাণুবাদের জনক জন ডাল্টন।
একটি মৌলের সব পরমাণুর আকার, ভর ও রাসায়নিক ধর্ম একই।
পদার্থের ভিন্নতার কারণ হলো এদের গঠন।
মরিচার রাসায়নিক নাম হাইড্রেটেড আয়রন অক্সাইড।
বায়ু এক ধরনের মিশ্র পদার্থ।
লবণ-পানির মিশ্রণে বিদ্যমান যৌগিক পদার্থ লবণ ও পানি।
সর্বপ্রথম ক্ষুদ্রতম কণার মতবাদ দেন ডেমোক্রিটাস।
ডেমোক্রিটাস পদার্থের ক্ষুদ্রতম কণার নাম দেন অ্যাটম বা পরমাণু।
একই পদার্থের পরমাণু যুক্ত হয়ে গঠিত হয় মৌলিক পদার্থ।
দুটি অক্সিজেন পরমাণুযুক্ত হয়ে গঠন করে অক্সিজেন অণু। (পদার্থের প্রকারভেদ)
একটি অক্সিজেন পরমাণু ও দুটি হাইড্রোজেন পরমাণু যুক্ত হয়ে গঠিত হয় পানির অণু।
এ পর্যন্ত আবিষ্কৃত মৌলিক পদার্থের সংখ্যা ১১৮।
প্রকৃতিতে প্রাপ্ত মৌলিক পদার্থের সংখ্যা ৯৮।
লবণের রাসায়নিক নাম সোডিয়াম ক্লোরাইড।
চিনির রাসায়নিক নাম সুক্রোজ।
লবণকে ভাঙলে পাওয়া যাবে সোডিয়াম ও ক্লোরিন।
চকের রাসায়নিক নাম ক্যালসিয়াম কার্বনেট।
কৃত্রিমভাবে তৈরি মৌলিক পদার্থ ২০টি।
ইলেকট্রন মাইক্রোস্কোপের সাহায্যে পরমাণু দেখা যায়।
পরমাণু ভেঙে পাওয়া যায় ইলেকট্রন, প্রোটন ও নিউট্রন।
পরমাণুর কেন্দ্রে থাকে নিউট্রন ও প্রোটন।
পরমাণুর কেন্দ্রের চারদিকে বৃত্তাকার কক্ষপথে ঘুরতে থাকে ইলেকট্রন। (পদার্থের প্রকারভেদ)
সর্বজনীন দ্রাবক হলো পানি।
জৈব ও অজৈব অনেক দ্রাবকে দ্রবীভূত করতে পারে পানি।
চিনি, ভিনেগার, স্পিরিট, গ্লুকোজ—এগুলো জৈব পদার্থ।
দুই বা ততোধিক পরমাণু যুক্ত হয়ে তৈরি করে অণু।
গ্যাসীয় মৌলের দুটি পরমাণু যুক্ত হয়ে গঠন করে গ্যাসীয় অণু।
পানির সংকেত H2o।
একটি যৌগ কী কী মৌল ও পরমাণুগুচ্ছ দিয়ে এবং কী অনুপাতে তৈরি বোঝা যায় যৌগিক পদার্থের সংকেত দ্বারা।
ডাল্টনের পরমাণুবাদ মতে, পরমাণু অবিভাজ্য অর্থাৎ একে ভাগ করা যায় না। যদিও আধুনিক বিজ্ঞান সেটা ভুল প্রমাণ করেছে।
জ্ঞানমূলক প্রশ্নোত্তর (পদার্থের প্রকারভেদ)
মরিচা কাকে বলে?
উত্তর : লোহার তৈরি জিনিসপত্র কিছুদিন বাইরে রেখে দিলে এর ওপর লালচে বাদামি একটি আস্তরণ পড়ে, একে মরিচা বলে। এর রাসায়নিক নাম হাইড্রেটেড আয়রন অক্সাইড। লোহার সঙ্গে বাতাসের অক্সিজেন ও পানির বিক্রিয়ায় এটি তৈরি হয়।
কোন মৌলের প্রোটন সংখ্যা ৮?
উত্তর : অক্সিজেনের প্রোটন সংখ্যা ৮।
ডাল্টনের পরমাণুবাদ কী?
উত্তর : পদার্থ অত্যন্ত ক্ষুদ্র পরমাণু দ্বারা গঠিত। একে আবার বিভাজন সম্ভব নয়। এ মতবাদই ডাল্টনের পরমাণুবাদ।
পর্যায় সারণি কী?
উত্তর : বিভিন্ন মৌলের মধ্যে ভৌত ও রাসায়নিক ধর্মের মিল এবং এসব ধর্মের ক্রমপরিবর্তন দেখানোর জন্য মৌলগুলোকে যে পর্যায় ও সারণিতে সাজানো হয়, সেটাকে পর্যায় সারণি বলে।
সর্বজনীন দ্রাবক কাকে বলে?
উত্তর : যে দ্রাবক অনেক জৈব ও অজৈব দ্রবকে দ্রবীভূত করে তাকে সর্বজনীন দ্রাবক বলে। যেমন পানি।
রাসায়নিক প্রতীক কাকে বলে?
উত্তর : কোনো মৌলের পূর্ণ নামের সংক্ষিপ্ত প্রকাশকে ওই মৌলের প্রতীক বলে। যেমন—অক্সিজেনের প্রতীক O।
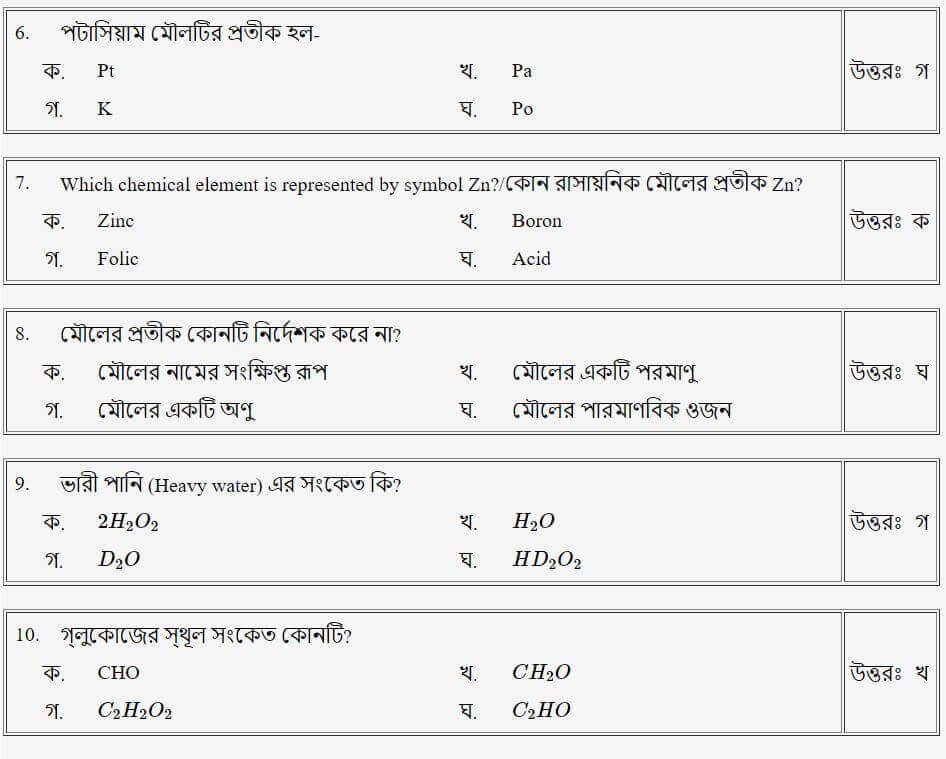
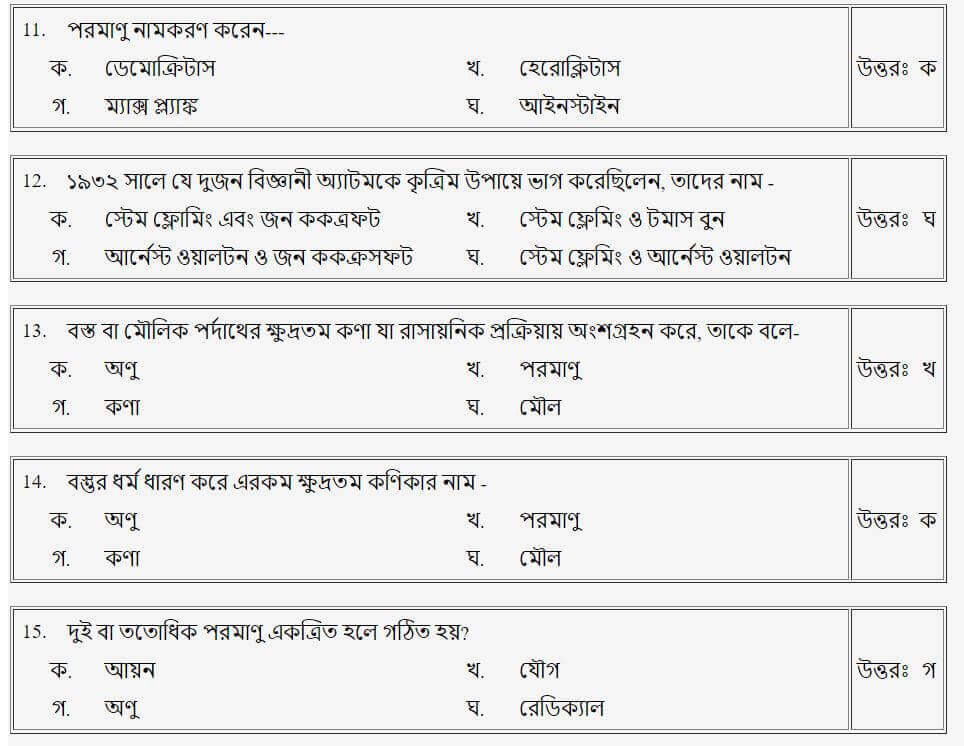
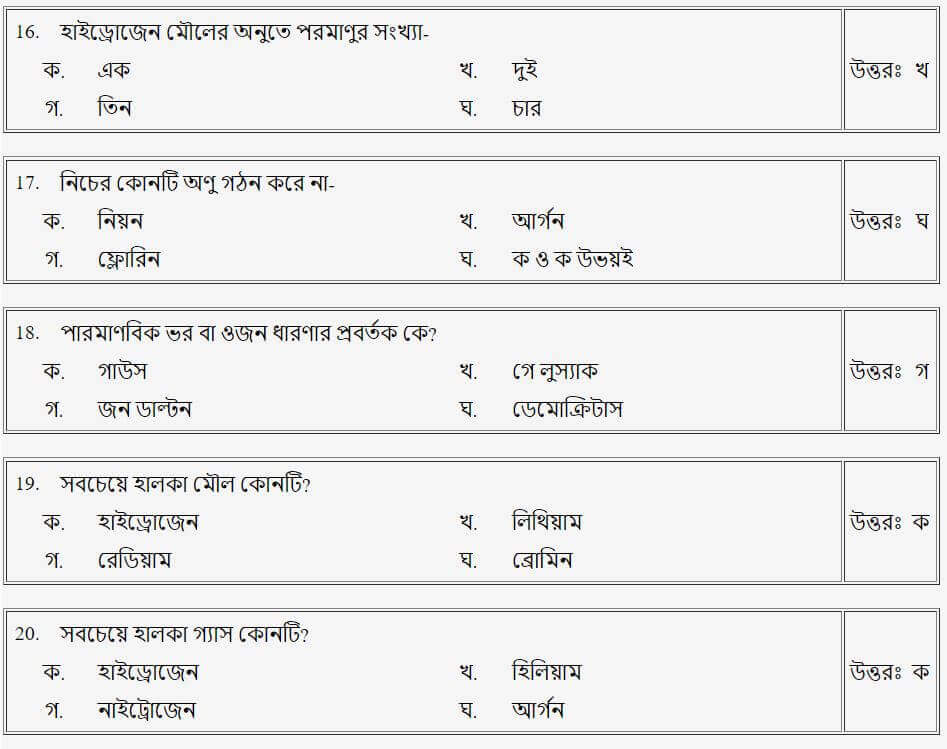
তাহলে চলো এবার আমরা Mcq এ দেখে নেই!!
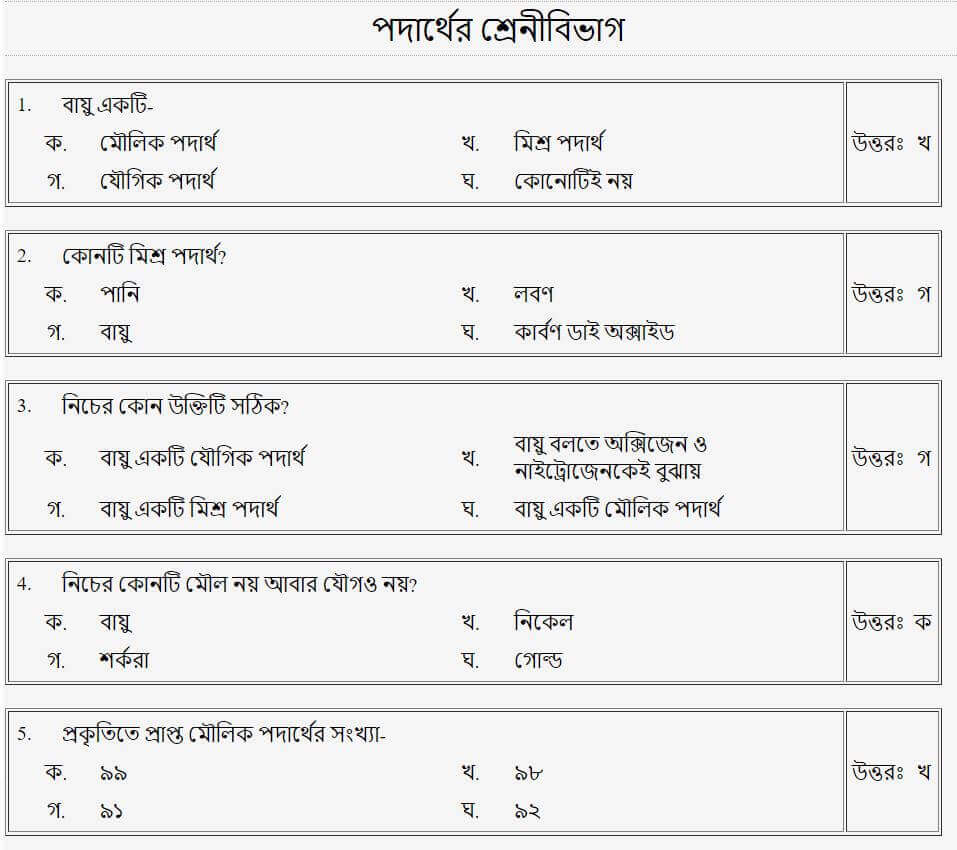
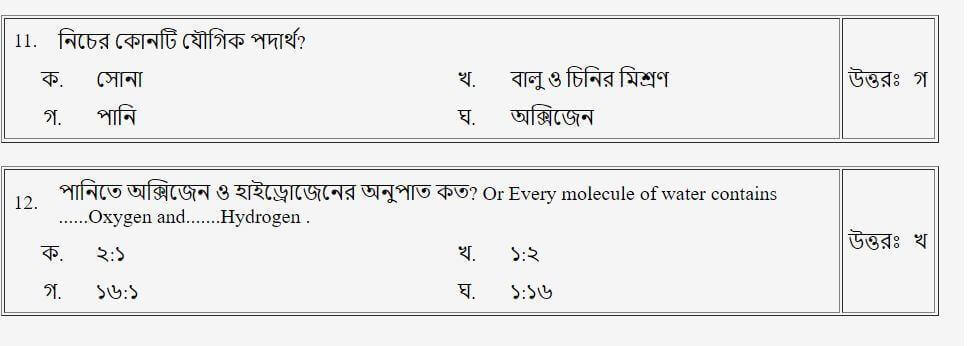
(পদার্থের প্রকারভেদ)
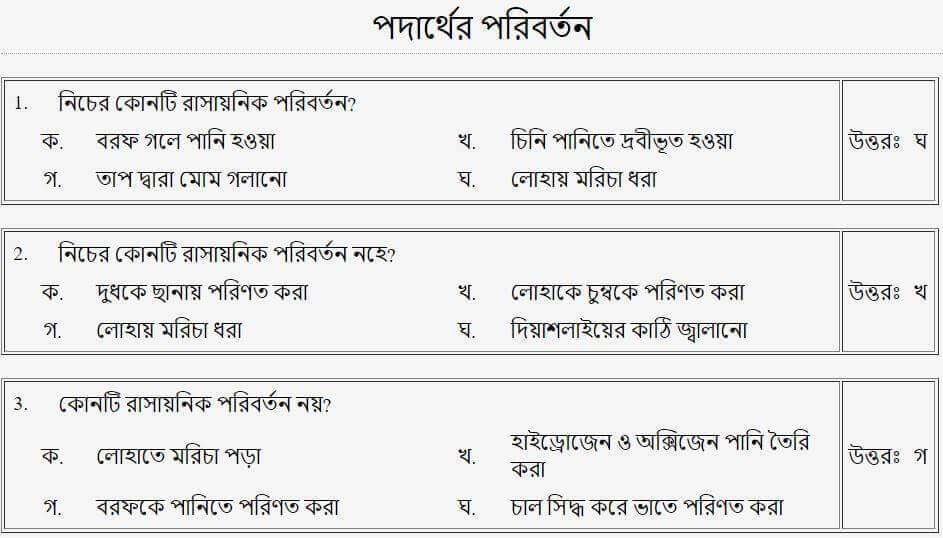
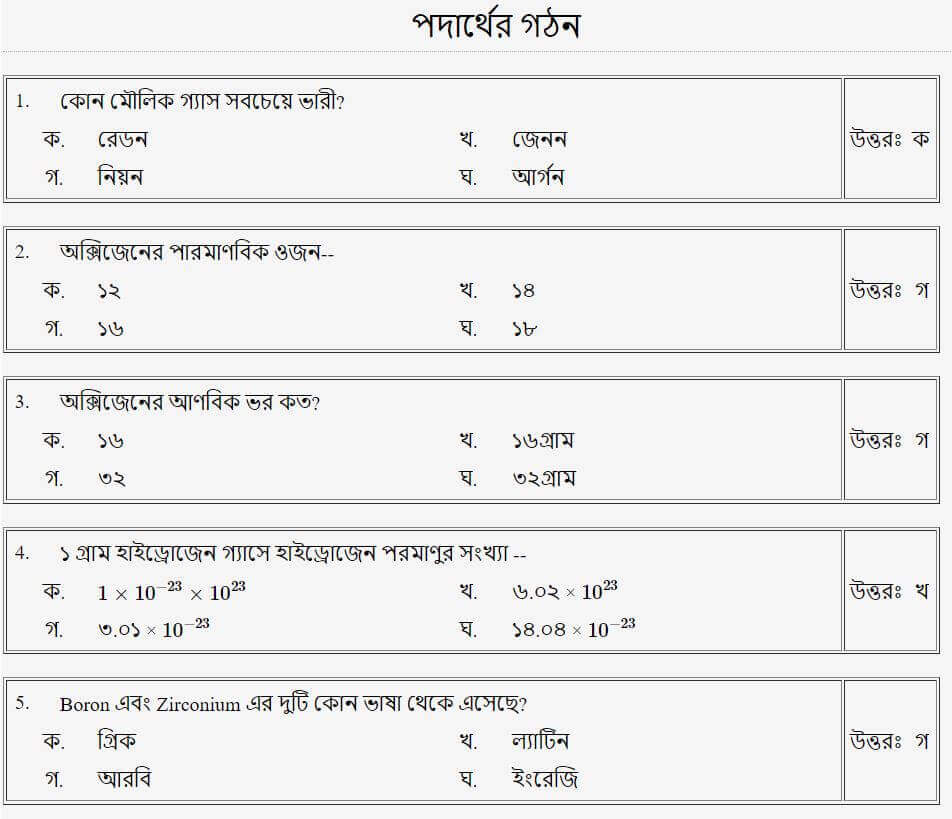
(পদার্থের প্রকারভেদ)
আমাদের পোষ্ট গুলো প্রতিনিয়ত আপডেট করা হয়। বিসিএস,প্রাইমারি সহ সব পরীক্ষার প্রতিনিয়ত প্রশ্ন অনুযায়ী পোষ্ট গুলো আমরা আপডেট করি। সবার জন্য শুভ কামনা রইলো।
